Lysineigenschaften, Struktur, Funktionen, Biosynthese
- 4893
- 789
- Said Ganzmann
Der Lysin (Lys, K) oder der ε-diaminoprosäure, Es ist eine der 22 Aminosäuren, die machen.
Es wurde 1889 von Drechsel als Produkt der Hydrolyse (Zersetzung) von Kaseinogen entdeckt. Jahre später stellten Fischer, Siegfried und Hedin fest, dass es auch Teil von Proteinen wie Gelatine, Eieralbumin, Conglutin, Fibrin und anderen Proteinen war.
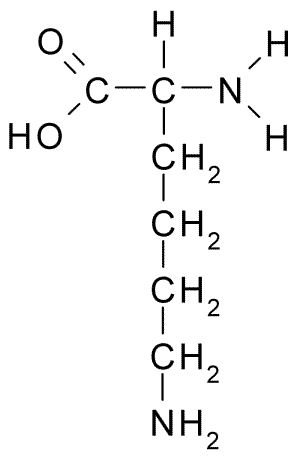
 Chemische Struktur des Aminosäure -Lysins (Quelle: Borb über Wikimedia Commons)
Chemische Struktur des Aminosäure -Lysins (Quelle: Borb über Wikimedia Commons) Sein Auftreten wurde dann in Samensamen in der Keimung und in den meisten pflanzlichen Proteinen nachgewiesen, was ihre Häufigkeit als allgemeines Bestandteil aller Zellproteine bestimmte.
Es gilt als eine der wichtigsten "begrenzenden" Aminosäuren in den Diäten, die reich an Getreide sind, und aus diesem Grund wird angenommen, dass die Qualität des Proteingehalt.
Einige Studien haben festgestellt, dass die Lysinaufnahme die Produktion und Freisetzung von Insulin- und Glucagon -Hormonen bevorzugt, was wichtige Auswirkungen auf den Energiestoffwechsel des Körpers hat.
[TOC]
Eigenschaften
Lysin ist eine positiv beladene α-Aminosäure.53, was impliziert, dass die physiologische pH -Wert Ihre Substituent -Aminogruppe vollständig ionisiert ist und Aminosäure eine positive Nettobelastung verleiht.
Das Auftreten in Proteinen verschiedener Arten lebender Organismen liegt bei nahezu 6% und verschiedene Autoren sind der Ansicht, dass Lysin für das richtige Wachstum und die Reparatur von Geweben von wesentlicher Bedeutung ist.
Die Zellen haben viele Lysinderivate, die eine große Vielfalt physiologischer Funktionen erfüllen. In diesen sind Hydroxilisin, Methyl-Lysin und andere.
Es handelt sich um eine ketogene Aminosäure, die impliziert, dass sein Stoffwechsel kohlensäurehaltige Skelette von Zwischensubstraten für Moleküle-Bildungsrouten wie Acetyl-CoA erzeugt, wobei die anschließende Bildung von Ketonkörpern in der Leber ist.
Im Gegensatz zu anderen essentiellen Aminosäuren ist dies keine glykogene Aminosäure. Mit anderen Worten, sein Abbau endet nicht mit der Produktion von Routenintermediären, die Glukose produzieren.
Struktur
Lysin wird innerhalb der Gruppe grundlegender Aminosäuren klassifiziert, deren Nebenketten ionisierbare Gruppen mit positiven Belastungen haben.
Die Seitenkette oder die R-Gruppe haben eine zweite primäre Amino-Gruppe, die in der ε-Position seiner aliphatischen Kette am Kohlenstoffatom gebunden ist, weshalb der Name „ε-Aminocaproico“ der Name „ε-Aminocaproico“ ist.
Es hat ein α-Kohlenstoffatom, zu dem ein Wasserstoffatom, eine Aminogruppe, eine Carboxylgruppe und die R-Seitenkette R, die durch die molekulare Formel (-Ch2-ch2-ch2-ch2-nH3+) gekennzeichnet ist.
Da die laterale Kette drei Methylengruppen hat und obwohl das Lysinmolekül eine Aminogruppe mit positiver Ladung zum physiologischen pH hat, hat diese Gruppe R einen starken hydrophoben Charakter, so dass sie in Proteinstrukturen oft „begraben“ wird und nur die ε- Aminogruppe.
Die Aminogruppe der Lysin -Seitenkette ist hochreaktiv und beteiligt sich normalerweise an den aktiven Zentren vieler Protein mit enzymatischer Aktivität.
Funktionen
Lysin, die eine essentielle Aminosäure ist, erfüllt mehrere Funktionen wie Mikronährstoff, insbesondere bei Menschen und anderen Tieren, aber es ist auch Metaboliten in verschiedenen Organismen wie Bakterien, Hefen, Pflanzen und Algen.
Die Eigenschaften seiner Seitenkette, insbesondere der der an der Kohlenwasserstoffkette gebundenen ε-Amino-Gruppe, die in der Lage ist, Wasserstoffbrücken zu bilden.
Es kann Ihnen dienen: Flora und Fauna von Zacatecas: repräsentativere ArtenEs ist sehr wichtig für das normale Wachstum und die Umgestaltung der Muskeln. Darüber hinaus handelt es sich um ein Vorläufermolekül für Carnitin, eine Verbindung, die in Leber, Gehirn und Nieren synthetisiert wurde, die für den Transport von Fettsäuren nach Mitochondrien für die Energieerzeugung verantwortlich sind.
Diese Aminosäure ist auch für die Synthese und Kollagenbildung erforderlich, ein wichtiges Protein des Bindegewebesystems im menschlichen Körper, sodass sie zur Aufrechterhaltung der Struktur von Haut und Knochen beiträgt.
Es hat experimentell anerkannte Funktionen in:
- Der Schutz des Darms gegen stressige Reize, Kontamination mit bakteriellen und viralen Krankheitserregern usw.
- Verringern Sie chronische Angstsymptome
- Bevorzugt das Wachstum von Säuglingen, die unter Diäten von geringer Qualität wachsen
Biosynthese
Menschen und andere Säugetiere können das Aminosäure -Lysin nicht synthetisieren In vivo Und aus diesem Grund müssen sie es von tierischen und pflanzlichen Proteinen erhalten, die mit Nahrung aufgenommen wurden.
In der natürlichen Welt haben sich für die Biosynthese von Lysin zwei verschiedene Wege entwickelt: eine, die Bakterien, Pflanzen und Pilze "niedriger" und eine von Euglénides und "überlegen" Pilze verwendet.
Lysinbiosynthese in Pflanzen, niedrigeren Pilzen und Bakterien
In diesen Organismen wird Lysin aus Diamineopimelsäure über einen 7 -stufigen Weg gewonnen. Für Bakterien impliziert dieser Weg beispielsweise die Produktion von Lysin mit Zwecken der (1) Proteinsynthese, (2) Synthese von Diaminopimellat und Synthese von (3) Lysin, die in der Zellwand von Pepidoglin verwendet werden wird.
Das Aspartat in Organismen, die diese Route präsentieren.
Die abweichende Route im Semiiard ASP.
Lysinbiosynthese in Superior- und Euglénidos -Pilzen
Lysinsynthese von novo In überlegenen Pilz- und Euglénid-Mikroorganismen tritt sie durch den L-α-Aminoadipato.
Die Route besteht aus 8 enzymatischen Schritten, an denen 7 freie Vermittler beteiligt sind. Die erste Hälfte der Route findet in den Mitochondrien statt und erreicht die Synthese von α-Aminoadipato. Die Umwandlung von α-Aminoadipato in L-Lisin erfolgt später im Cytosol.
- Der erste Schritt der Route besteht aus der Kondensation der α-Ketoglutarat- und Acetyl-CoA.
- Homocitricsäure ist in Säure dehydriert Cis-Homoakonitisch, das dann durch ein Homoaconitasa -Enzym in Homoisocitricsäure umgewandelt wird.
- Homoisocitricsäure wird durch Homoisocytrat-Dehydrogenase oxidiert, die eine transsitorische Oxyglutaratbildung erreicht, die ein Kohlendioxidmolekül (CO2) verliert und als α-Kataadipinsäure endet.
- Diese letzte Verbindung wird dank der Wirkung des Aminotransferase-Aminoadipat-Enzyms, das L-α-Aminoadipinsäure erzeugt.
- Die laterale Kette der L- & agr; -Aminoadipinsäure wird reduziert, um L-α-Aminoadipic-Δ-Semi-Assiss zu bilden.
- Sacoopinreduktase dann Katalyz. Anschließend ist das Imino reduziert und der Sacoopin wird erhalten.
- Schließlich wird die Kohlenstoff-Stickstoffbindung im Portionglutamat von Sacaopin durch die Enzym Sacraopin-Dehydrogenase "geschnitten", die als Endprodukte L-Lisin und α-Zetoglutarat-Säure ergeben.
Alternativen zu Lysin
Experimentelle Tests und Analysen, die mit Ratten in einem Wachstumsphase durchgeführt wurden-N-Acetyl-Lysin kann Lysin ersetzen, um das Wachstum von Jung und dies dank des Vorhandenseins eines Enzyms zu unterstützen: ε-Lisinakilase.
Es kann Ihnen dienen: Affotische Zone: Eigenschaften, Flora, FaunaDieses Enzym katalysiert die Hydrolyse des ε-N-Acetyllysin zur Herstellung von Lysin und so schnell und in reichlich Mengen.
Degradierung
Bei allen Säugetierarten wird der erste Schritt beim Lysinabbau durch die Lysin-2-Oxoglutarat-Enzymreduktase katalysiert, die Lysin und α-Oxoglutarat in Sacalopin umwandeln kann In den späten 60ern.
Sacroopin ist zurück zu α-Aminoadipato Δ-semialdehid und glutamat durch Wirkung des Enzyms Sacaropin-Dehydrogenase. Ein anderes Enzym kann Sacaropina als Substrat zu Hydrolyz verwenden.
Sacaropin, eine der wichtigsten metabolischen Vermittler bei der Lysinabbau, hat eine Ersatzrate unter extrem hocher physiologischer Bedingungen, sodass es sich nicht in Flüssigkeiten oder Geweben ansammelt, was durch die hohen Aktivitäten des Entwicklerdehydrogenase nachgewiesen wurde.
Die Menge und Aktivität der am Stoffwechsel von Lysin beteiligten Enzymen hängt jedoch in hohem Maße von verschiedenen genetischen Aspekten jeder bestimmten Spezies ab, da es intrinsische Variationen und spezifische Kontroll- oder Regulierungsmechanismen gibt.
"Sacaropinurie"
Es gibt einen pathologischen Zustand im Zusammenhang mit dem reichlichen Verlust von Aminosäuren wie Lysin, Citrulin und Histidin durch Urin, und dies ist als "Saropinurie" bezeichnet. Sacaropin ist ein Aminosäurerivat des Lysinstoffwechsels, der zusammen mit den drei im Urin von "Saropinuric" -Patienten erwähnten Aminosäuren ausgeschieden wird.
Sacaropin wurde anfänglich in Bierhefe entdeckt und ist ein Vorläufer von Lysin in diesen Mikroorganismen. In anderen eukaryotischen Organismen wird diese Verbindung während des Abbaus von Lysin in den Mitochondrien der Hepatozyten erzeugt
Lebensmittel, die reich an Lysin sind
Lysin wird aus dem mit der Ernährung konsumierten Lebensmittel und einem durchschnittlichen erwachsenen Menschen mindestens 0 gewonnen.8 g dieses Tages. Es kommt in zahlreichen Proteinen tierischer Herkunft vor, insbesondere in rotem Fleisch wie Kuh, Lamm und Hühnchen.
Es ist in Fischen wie Thunfisch und Lachs und in Früchten des Meeres wie Austern, Garnelen und Muscheln. Es ist auch in den konstituierenden Proteinen von Milchprodukten und ihren Derivaten vorhanden.
In Pflanzenfutter befindet sich in den Kartoffeln, in Paprika und in Lauch. Es ist auch in Avocados, Pfirsiche und Birnen. In Hülsenfrüchten wie Arriñonados -Bohnen, Kichererbsen und Soja; In Kürbiskerne, in den Nüssen von Macadamia und in den Anakardos (Merey, Marañón usw.).
Vorteile Ihrer Aufnahme
Diese Aminosäure ist in zahlreichen Medikamenten zur Nutrazeutischen Formulierung enthalten, dh aus natürlichen Verbindungen, insbesondere Pflanzen, isoliert.
Es wird als antikonvulsiv verwendet und seine Wirksamkeit wurde auch bei der Hemmung der Replikation des Herpes Simplex Virus Typ 1 (HSV-1), der sich normalerweise in Momenten des Stresses manifestiert, wenn das Immunsystem als Ampullen oder Herpes auf den Lippen depressiv oder "geschwächt" wird.
Die Wirksamkeit von L-Lisine-Nahrungsergänzungsmitteln zur Behandlung von Lippenherpes ist auf die Tatsache zurückzuführen, dass dies Arginin "konkurriert" oder "blockiert", eine andere Proteinaminosäure, die für die Multiplikation von HSV-1 erforderlich ist.
Es wurde festgestellt, dass Lysin auch Anti-Ansoolit-Wirkungen hat, da es hilft, Rezeptoren zu blockieren, die an Reaktionen auf verschiedene stressige Reize beteiligt sind, zusätzlich zur Teilnahme an der Abnahme des Cortisolspiegels "Stresshormon".
Einige Studien haben gezeigt, dass dies für die Hemmung krebserzeugender Tumoren, für die Gesundheit der Augen, für die Blutdruckkontrolle nützlich sein kann, unter anderem für die Blutdruckkontrolle.
Kann Ihnen dienen: Kulturmedien: Geschichte, Funktion, Typen, VorbereitungBei Tieren
Eine häufige Strategie zur Behandlung von Herpes -I -Virusinfektionen in Katzen ist die Lysin -Supplementierung. Einige wissenschaftliche Veröffentlichungen stellen jedoch fest, dass diese Aminosäure in den Fällen keine antivirale Eigenschaft aufweist, sondern durch Verringerung der Argininkonzentration wirkt.
Bei der Gesundheit von Säuglingen
Die experimentelle Einnahme von L-Lisina, die während der Stillzeit in Kindermilch hinzugefügt wurde.
Der Überschuss an L-Lisine kann jedoch übertriebene Urinausscheidungen von Aminosäuren, sowohl neutralen als auch grundlegenden Eigenschaften, verursachen, was zu einem Körperungleichgewicht von ihnen führt.
Der Überschuss der L-Lisine-Supplementierung kann bei der Repression von Wachstum und anderen histologischen Wirkungen in wichtigen Organen enden, wahrscheinlich aufgrund des Verlusts von Aminosäuren mit Urin.
In derselben Studie wurde auch gezeigt, dass die Lysin -Supplementation die Ernährungseigenschaften von pflanzlichen Proteinen verbessert.
Andere ähnliche Studien, die bei Erwachsenen und Kindern beider Geschlechter in Ghana, Syrien und Bangladesch durchgeführt wurden.
Lysinmangelerkrankungen
Lysin ist wie alle essentiellen und nicht essentiellen Aminosäuren, die für die korrekte Synthese von Zellproteinen erforderlich sind, die zur Bildung von Körper organischen Systemen beitragen.
Markierte Lysinmängel in der Ernährung, da es sich um eine essentielle Aminosäure handelt, die nicht vom Körper erzeugt wird, kann zusätzlich zu Durchfall, die auch mit Serotoninrezeptoren verbunden sind.
Verweise
- Schüssel, s., & Bunnik und. M. (2015). Die Lysin -Flächen ist für die Prävention oder Behandlung von katzenartigen Herpesvirus 1 -Infektionen bei Katzen nicht wirksam: eine systematische Überprüfung. BMC Veterinärforschung, elf(1).
- Carson, n., Knusprig, b., Neill, d., & Carré, ich. (1968). Saccharopinurie: Ein neuer angeborener Fehler des Lysin -Stoffwechsels. Natur, 218, 679.
- Colina R, J., Díaz e, m., Manzanilla m, l., Araque m, h., Martínez G, G., Rossini V, m., & Jerez-Timaure, n. (2015). Bewertung des verdaulichen Lysinspiegels in Diäten mit hoher Energiedichte zum Abschluss von Schweinen. MVZ Córdoba Magazine, zwanzig(2), 4522.
- Fellows, b. F. C. Yo., & Lewis, m. H. R. (1973). Lysin -Metabolismus bei Säugetieren. Journal Biochemical, 136, 329-334.
- Fornazier, r. F., Azevedo, r. ZU., Ferreira, r. R., & Varisi, v. ZU. (2003). Lysinkatabolismus: Fluss, metabolische Rolle und Regulierung. Brasilianische Zeitschrift für Pflanzenphysiologie, fünfzehn(1), 9-18.
- Ghosh, s., Smriga, m., VUVOR, f., Suri, d., Mohammed, h., Armah, s. M., & Scrimshaw, n. S. (2010). Auswirkung der Lysin-Anleihe auf Gesundheit und Morbidität bei Probanden, die von schlechten peri-städtischen Haushalten in Accra, Ghana, gehören. American Journal of Clinical Nutrition, 92(4), 928-939.
- Hutton, c. ZU., Perugini, m. ZU., & Gerrard, J. ZU. (2007). Hemmung der Lysinbiosynthese: Eine sich entwickelnde Antibiotika -Strategie. Molekulare Biosysteme, 3(7), 458-465.
- Kalogeropoul, d., Lafave, l., Schweim, k., Gannon, m. C., & Nuttall, f. Q. (2009). Die Einnahme von Lysin schwächert die Glukosereaktion auf aufgenommene Glukose ohne Veränderung der Insulinreaktion deutlich ab. American Journal of Clinical Nutrition, 90(2), 314-320.
- Nagai, h., & Takeshita, s. (1961). Ernährungswirkung der L-Lysin-Supplementierung auf das Wachstum von Säuglingen und Kindern. Japanische Paediatria, 4(8), 40-46.
- O'Brien, s. (2018). Gesundheit. Abgerufen am 4. September 2019 von www abgerufen.Gesundheit.COM/Nutrition/Lysin-Nutzen
- Zabriskie, t. M., & Jackson, m. D. (2000). Lysinbiosynthese und Stoffwechsel in Pilzen. Naturproduktberichte, 17(1), 85-97.
- « Die 25 berühmtesten Hacker der Geschichte
- Freud- und Psychoanalyse -Abwehrmechanismen (Beispiele) »

