Smozymeigenschaften, Struktur, Funktionen
- 1590
- 73
- Said Ganzmann
Der Smozyme Sie sind hydrolytische Enzyme, die in der Natur weit verbreitet sind. Sie sind in Pflanzen und Tieren vorhanden und fungieren als Abwehrmechanismus gegen bakterielle Infektionen.
Die Entdeckung dieser Enzyme stammt aus dem Jahr 1922, als Alexander Fleming feststellte.
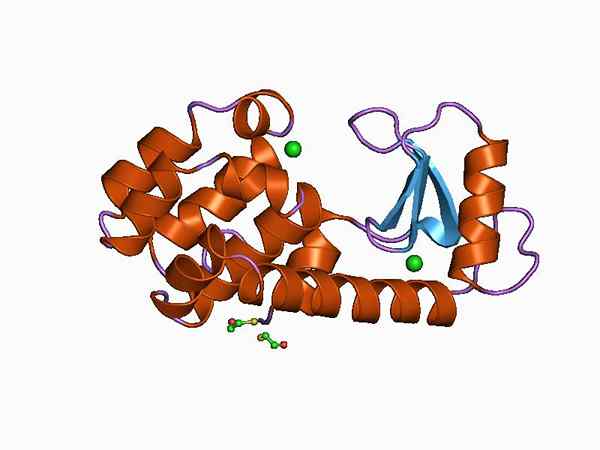
 Grafische Darstellung der Struktur der Glätte (Quelle: Jawahar Swaminathan und MSD -Mitarbeiter am Europäischen Bioinformatikinstitut [Public Domain] über Wikimedia Commons)
Grafische Darstellung der Struktur der Glätte (Quelle: Jawahar Swaminathan und MSD -Mitarbeiter am Europäischen Bioinformatikinstitut [Public Domain] über Wikimedia Commons) Dank seiner einfachen Erhaltung und seiner geringen Größe, die Lysozy. Es wird derzeit als Modellsystem in Chemie, Enzym, Kristallographie und Proteinmolekularbiologie verwendet.
Smozym ist ein "bakteriolithisches" Enzym.
Es hat verschiedene Funktionen, sowohl Verdauung als auch immunologisch, in allen Organismen, in denen es für mehrere Zwecke als biotechnologische Ressource ausgedrückt und verwendet wird.
[TOC]
Eigenschaften
Die Glätte wird von den Hauptgruppen lebender Organismen auf dem Planeten ausgedrückt, sind jedoch bei Tieren besonders reichlich vorhand.
Beim Menschen befindet sich das Lyszym in hohen Konzentrationen in verschiedenen Flüssigkeiten und Geweben wie Leber, Knorpel, Speichel, Schleim und Tränen. Es wird von hämatopoetischen Zellen exprimiert und auch in Granulozyten, Monozyten und Makrophagen sowie in anderen Vorläuferzellen des Knochenmarks gefunden.
Kann Ihnen dienen: raues endoplasmatisches RetikulumSmozyme von pflanzlichen Ursprungs hydrolysieren Substrate, ähnlich denen, die von anderen eng verwandten Enzymen, die als Chitinasen bekannt sind.
Arten von Glätte bei Tieren und deren Eigenschaften
Im Tierreich wurden mindestens drei Arten von Glätte beschrieben:
-Das glatte C ("C" von "COnventional "oder"CHicken ", Was bedeutet Hühnchen auf Englisch)
-Das Smozym G ("G" von "GOose”, Was Gans auf Englisch bedeutet) und
-Der glatte Typ I ("I" von "YoNvertebrate “)
Die drei Klassen von Smoothies unterscheiden sich in Bezug auf ihre Aminosäuresequenzen, ihre biochemischen Eigenschaften und ihre enzymatischen Eigenschaften.
Abläufe Typ c
Diese Glätte gelten als „Modell“ Enzyme dieser Familie, da sie als Modell für Struktur- und Funktionsstudien gedient haben. Sie sind als Typ "C" des Englischen bekannt "Chickn"Da sie zum ersten Mal aus Hühnereiern isoliert wurden.
In dieser Klasse sind die Glätte von den meisten Wirbeltieren, insbesondere von Vögeln und Säugetieren. Es umfasst auch Enzyme, die in einigen Arthropoden wie Lepidoptera, Diptera, einigen Arachnids und Krebstieren vorhanden sind.
Sie sind kleine Enzyme, weil sie ein Molekulargewicht haben, das 15 kDa nicht überschreitet. Sie sind grundlegende Proteine mit hohen isoelektrischen Punkten.
Abläufe Typ G
Die erste Glätte dieses Typs wurde im Ei klar identifiziert.
In einigen Fällen sind die glatten Gy -Typen häufiger als Smooths vom Typ C in den Eiweiß bestimmter Vögel, während das Gegenteil auftritt, sind die glatten Cs des Typs C häufiger vorhanden.
Kann Ihnen dienen: lenticelaDiese Glätte sind auch in Muscheln und einigen Tunikaten vorhanden. Sie sind etwas größere Proteine als die vom Typ C, aber ihr Molekulargewicht überschreitet normalerweise nicht 25 kDa.
Slrears Typ I
Diese Glätte sind hauptsächlich bei Tieren von Wirbellosen vorhanden. Seine Anwesenheit wurde in Anélidos, Echinoderms, Krebstieren, Insekten, Mollusken und Nematoden bestimmt und fehlt bei Säugetieren und anderen Wirbeltieren.
Sie haben saurere isoelektrische Punkte als die von Proteinen vom Typ C und Typ G.
Struktur
Die drei im vorherigen Abschnitt beschriebenen Arten von tierischen Enzymen haben ziemlich ähnliche dreidimensionale Strukturen.
Die Glätte des Menschen ist ein glattes Typ C und war das erste dieser Enzyme, die untersucht und strukturell charakterisiert wurden. Es handelt.
Seine Struktur ist in zwei Domänen unterteilt: eine bekannte als Domäne α Und ein anderer wie β -Domäne. Die α -Domäne besteht aus vier Alpha -Hallen und der β -Domäne, die durch ein Antiparallela -β -Blatt und eine große Schleife gebildet wird.
Die katalytische Stelle des Enzyms befindet sich in der Spalte, die zwischen beiden Domänen gebildet wird, und für die Kreuzung mit dem Substrat hat Glutaminsäure und Asparaginsäure Verschwendung. Darüber hinaus verfügt es über mindestens sechs „Subsitios“.
Funktionen
Die Glätte hat nicht nur physiologische Funktionen im Schutz und im Kampf gegen bakterielle Infektionen in den Organismen, die sie ausdrücken, sondern, wie es kommentiert wurde.
Kann Ihnen dienen: Epithelzellen PlattenepithelIn der gegenwärtigen Branche wird es als starkes Bakterizid anerkannt und zur Erhaltung von Nahrungsmitteln und Drogen verwendet.
Dank der Reaktion, die diese Enzyme katalysieren können, können sie auf verschiedene Bakterienpopulationen wirken und die Stabilität ihrer Wände verändern, die sich anschließend in Zelllyse niederlassen.
In Verbindung mit anderen ähnlichen Enzymen kann die Glätte sowohl auf grampositive Bakterien als auch auf gramnegative Bakterien wirken, sodass sie als Teile des antibakteriellen "Immun" -Systems verschiedener Arten von Organismen betrachtet werden können.
In den im Blut von Säugetieren vorhandenen weißen Blutkörperchen haben diese Enzyme wichtig.
Smozyme in Pflanzen erfüllen im Wesentlichen die gleichen Funktionen wie bei den Tieren, die sie ausdrücken, da sie als erste Verteidigungslinie gegen bakterielle Krankheitserreger sind.
Verweise
- Callewaert, l., & Michels, w. (2010). Lysozyme im Tierreich. J. Biosci., 35(1), 127-160.
- Merlini, g., & Bellotti, v. (2005). Lysozym: ein paradigmatisches Molekül zur Erforschung der Proteinstruktur, Funktion und Fehlfaltung. Chemische Klinik, 357, 168-172.
- Suchen. (1977). Lysozym: Eine kurze Bewertung. Postgraduierte medizinisches Journal, 53, 257-259.
- Sahoo, n. R., Kumar, p., Bhusan, geb., Bhattacharya, t. K., Tagal, s., & Sahoo, m. (2012). Lysozym im Vieh: Eine Anleitung zur Auswahl -Forase. Journal of Animal Science Fortschritte, 2(4), 347-360.
- Wohlkönig, a., Huet, J., Looze und., & Wintjens, r. (2010). Strukturbeziehungen in der Lysozym -Superfamilie: bedeutende Hinweise auf Glykosidhydrolase -Signaturmotive. Plus eins, 5(11), 1-10.
- « Oyamel -Merkmale, Lebensraum und Verteilung, verwendet
- Nuklearporeneigenschaften, Funktionen, Komponenten »

