Atommassendefinition, Typen, wie man sie berechnet, Beispiele
- 2628
- 554
- Medine Kedzierski
Der Atommasse Es ist die Menge an Materie, die in einem Atom vorhanden ist, das in gewöhnlichen physischen Einheiten oder in Atommasseneinheiten (Uma oder U) ausgedrückt werden kann. Ein Atom ist in fast seiner gesamten Struktur leer; Elektronen, die in Regionen, die als Orbital bezeichnet werden, verschwommen sind, wo es eine gewisse Wahrscheinlichkeit gibt, sie zu finden, und ihr Kern.
Im Kern des Atoms befinden sich Protonen und Neutronen; Die erste mit positiven Gebühren, während die Sekunden mit neutraler Last. Diese beiden subatomaren Partikel haben eine viel größere Masse als die des Elektrons; Daher wird die Masse eines Atoms von seinem Kern und nicht durch die Leere oder Elektronen bestimmt.
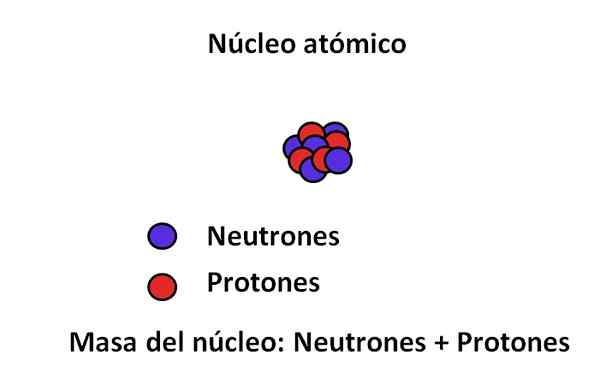
 Die wichtigsten subatomaren Partikel und die Masse des Kerns. Quelle: Gabriel Bolívar.
Die wichtigsten subatomaren Partikel und die Masse des Kerns. Quelle: Gabriel Bolívar. Die Masse eines Elektrons beträgt ungefähr 9,1 · 10-31 kg, während der Proton 1,67 · 10-27 kg, das Massenverhältnis von 1 ist.800; das heißt, ein Proton "wiegt" 1.800 Mal mehr als ein Elektron. Ebenso passiert dasselbe mit den Massen von Neutronen und Elektronen. Deshalb wird der Massenbeitrag des Elektrons für gewöhnliche Zwecke als vernachlässigbar angesehen.
Aus diesem Grund wird normalerweise angenommen, dass die Masse des Atoms oder die Atommasse nur von der Masse des Kerns abhängt; was wiederum aus der Summe des Themas von Neutronen und Protonen besteht. Aus dieser Argumentation entstehen zwei Konzepte: Massenzahl und Atommasse, beide eng verwandt.
So viel "leer" in Atomen und da seine Masse fast ausschließlich der Kern ist, wird erwartet, dass letztere außerordentlich dicht sein wird.
Wenn wir diese Leere an einen Körper oder Objekt bringen, wären seine Dimensionen drastisch. Wenn wir auch ein kleines Objekt bauen könnten, das auf Atomkern (ohne Elektronen) basiert, dann hätte dies eine Masse von Millionen von Tonnen.
Andererseits helfen Atommassen dabei, verschiedene Atome von demselben Element zu unterscheiden. Dies sind die Isotope. Ein Durchschnitt der Atommassen für ein bestimmtes Element muss geschätzt werden. Durchschnitt, der von Planet auf Planet oder von einer Raumregion zu einem anderen variieren kann.
[TOC]
Definition und Konzept

Per Definition ist die Atommasse die Summe der Massen ihrer Protonen und Neutronen, die mit Uma oder U ausgedrückt werden. Die resultierende Zahl (auch als Massenzahl bezeichnet) wird in der oberen linken Ecke in der Notation für Nukleids dimensionlos platziert. Zum Beispiel für das Element fünfzehnX Die Atommasse beträgt 15 ° oder 15U.
Atomare Masse kann nicht viel über die wahre Identität dieses Elements x aussagen. Stattdessen wird eine Atomzahl verwendet, die den Protonen entspricht, die den Kern von x beherbergen. Wenn diese Zahl 7 ist, beträgt die Differenz (15-7) 8; Das heißt, X hat 7 Protonen und 8 Neutronen, deren Summe 15 ist.
Als Rückkehr zum Bild hat der Kern 5 Neutronen und 4 Protonen, so dass seine Massenzahl 9 beträgt. Und in Kurve 9 ist Uma die Masse seines Atoms. Mit 4 Protonen und der Beratung der periodischen Tabelle ist ersichtlich, dass dieser Kern dem Berylliumelement entspricht, sein (oder 9SEI).
Atomare Masseneinheit
Atome sind zu klein, um ihre Massen durch herkömmliche Methoden oder gewöhnliche Skalen zu messen. Aus diesem Grund wurde der Uma oder O da (Daltón) erfunden. Diese für Atome entwickelten Einheiten ermöglichen es Ihnen, eine Vorstellung davon zu haben, wie massiv die Atome eines Elements in Bezug aufeinander sind.
Kann Ihnen dienen: Kobalt: Struktur, Eigenschaften, AnwendungenAber was genau ein Uma repräsentiert? Es muss eine Referenz geben, mit der Sie Massenbeziehungen aufbauen können. Dazu wurde das Atom als Referenz verwendet 12C, das ist das häufigste und stabilste Isotop für Kohlenstoff. Mit 6 Protonen (ihre Atomzahl Z) und 6 Neutronen beträgt die Atommasse also 12.
Es wird angenommen, dass Protonen und Neutronen die gleichen Massen haben, so dass jeder Beitrag 1 Uma. Die Einheit der Atommasse wird dann als zwölf Teil (1/12) der Masse A Carbon-12-Atom definiert; Dies ist die Masse eines Protons oder eines Neutrons.
Äquivalenz in Gramm
Und nun stellt sich die folgende Frage: Wie viele Gramm entsprechen 1 Uma? Da es zunächst keine Techniken vorangebracht gab, um es zu messen, mussten sich die Chemikalien damit zufrieden geben, alle Massen mit Uma auszudrücken. Dies war jedoch ein Vorteil und kein Nachteil.
Weil? Denn als kleine subatomare Teilchen, genau wie ein Kind, muss es ihre Masse in Gramm ausgedrückt sein. Tatsächlich entspricht 1 Uma 1.6605 · 10-24 Gramm. Darüber hinaus war es mit dem Einsatz des Konzepts von Mol kein Problem, die Massen der Elemente und deren Isotope mit Uma zu bearbeiten, wusste, dass solche Einheiten zu g/mol modifiziert werden könnten.
Zum Beispiel zurückkommen zu fünfzehnX und 9Sei, wir haben, dass ihre Atommassen 15 Uma bzw. 9 Uma sind. Da diese Einheiten so klein sind und nicht sagen, wie viel Materie man "wiegen" muss, um sie zu manipulieren, verwandeln sie sich in ihre jeweiligen Molmassen: 15 g/mol und 9 g/mol (Einführung der Konzepte von Mol und Avogadro -Zahl).
Durchschnittliche Atommasse
Nicht alle Atome desselben Elements haben die gleiche Masse. Dies bedeutet, dass sie im Kern mehr subatomare Partikel haben müssen. Da das gleiche Element das gleiche Element ist, muss die Atomzahl oder Anzahl der Protonen konstant bleiben. Daher gibt es nur Unterschiede in den Mengen von Neutronen, die besitzen.
Somit erscheint es von der Definition von Isotopen: Atome desselben Elements, jedoch mit unterschiedlichen Atommassen. Zum Beispiel besteht Beryllium fast ausschließlich aus dem Isotop 9Sei mit Spuren von Spuren 10Sei. Dieses Beispiel hilft jedoch nicht viel, das Konzept der durchschnittlichen Atommasse zu verstehen. Wir brauchen einen mit mehr Isotopen.
Beispiel
Angenommen, das Element existiert 88J, dies ist das Hauptisotop von J mit einer Fülle von 60%. J hat zusätzlich zwei weitere Isotope: 86J, mit einer Fülle von 20%und 90J mit einer Fülle auch 20%. Dies bedeutet, dass von 100 J Atomen, die wir auf der Erde sammeln, 60 davon sind 88J und die restlichen 40 eine Mischung von 86J und 90J.
Jede der drei Isotope von J hat eine eigene Atommasse; Das heißt, seine Summe von Neutronen und Protonen. Diese Massen müssen jedoch gemittelt werden, um ein Atommasse für J zu haben. Hier auf Erden, da es andere Regionen des Universums geben kann, in denen die Fülle von 86J ist 56% und nicht 60%.
Kann Ihnen dienen: Natrium: Geschichte, Struktur, Eigenschaften, Risiken und VerwendungUm die durchschnittliche Atommasse von J zu berechnen, muss der gewichtete Durchschnitt der Massen ihrer Isotope erhalten werden; Das heißt, unter Berücksichtigung des Prozentsatzes der Fülle für jeden von ihnen. So haben wir:
Durchschnittliche Masse (j) = (86 Uma) (0,60) + (88 Uma) (0,20) + (90 Uma) (0,20)
= 87,2 Uma
Das heißt, die durchschnittliche Atommasse (auch als j bekannt als J ist 87,2 Uma. Inzwischen beträgt die Molmasse 87,2 g/mol. Beachten Sie, dass 87,2 näher als 88 als 86 ist und auch von 90 entfernt ist.
Absolute Atommasse
Absolute Atommasse ist die Atommasse, die in Gramm exprimiert wird. Ausgehend vom Beispiel des hypothetischen Elements können wir seine absolute Atommasse (durchschnittlich) berechnen, wenn wir wissen, dass jedes Uma 1.6605 · 10 äquivalent ist-24 Gramm:
Absolute Atommasse (j) = 87,2 Uma * (1.6605 · 10-24 g/ Uma)
= 1,447956 · 10-22 g/atom j
Dies bedeutet, dass J -Atome im Durchschnitt eine absolute Masse von 1,447956 · 10 haben-22 G.
Relative Atommasse
Die relative Atommasse ist identisch mit der durchschnittlichen Atommasse für ein bestimmtes Element; Im Gegensatz zum zweiten fehlt jedoch der erste Einheit. Daher ist es dimensionlos. Beispielsweise beträgt die durchschnittliche Atommasse von Beryllium 9.012182 U; während seine relative Atommasse einfach 9.012182 beträgt.
Deshalb verstehen diese Konzepte manchmal normalerweise als Synonyme, da sie sehr ähnlich sind und die Unterschiede zwischen ihnen subtil sind. Aber was sind diese Massen relativ? Relativ zum zwölf Teil der Masse der Masse 12C.
Ein Element mit einer relativen Atommasse von 77 bedeutet also, dass es eine Masse von 77 -mal größer als 1/12 Teil der hat 12C.
Diejenigen, die die Elemente im Periodenzüchter verdient haben, können erkennen, dass ihre Massen relativ ausgedrückt werden. Sie haben keine Uma -Einheiten und es wird als: Eisen eine Atommasse von 55.846, was bedeutet, dass es 55.846 -mal massiver ist als die Masse von 1/12 Teil des 12C, und das kann auch als 55.846 Uma oder 55.846 g/mol ausgedrückt werden.
Wie man die Atommasse berechnet
Mathematisch ein Beispiel dafür, wie man es mit dem Beispiel des Elements j berechnet. Im Allgemeinen muss die gewichtete durchschnittliche Formel angewendet werden, was wäre:
P = σ (Isotope -Atommasse) (Häufigkeit in Dezimalstellen)
Mit anderen Worten, die Atommassen (Neutronen + Protonen) jedes Isotops (gewöhnlich natürlich) für ein bestimmt.
Und warum nicht einfach der arithmetische Durchschnitt?? Zum Beispiel beträgt die durchschnittliche Atommasse von J 87,2 Uma. Wenn wir diese Masse wieder berechnen, aber auf arithmetische Weise werden wir:
Durchschnittliche Masse (j) = (88 Uma + 86 Uma + 90 Uma)/3
= 88 Uma
Beachten Sie, dass es einen wichtigen Unterschied zwischen 88 und 87.2 gibt. Dies liegt daran, dass im arithmetischen Durchschnitt angenommen wird, dass die Häufigkeit aller Isotope gleich ist; Wenn es drei J -Isotope gibt, muss jeder eine Fülle von 100/3 (33,33%) haben. Aber es ist nicht wirklich: Es gibt viel reichhaltigere Isotope als eine andere.
Es kann Ihnen dienen: Urethan: Struktur, Eigenschaften, erhalten, verwendet, verwendetDeshalb wird der gewichtete Durchschnitt berechnet, da er berücksichtigt wird, wie reichlich häufig ein Isotop in Bezug auf einen anderen ist.
Beispiele
Kohlenstoff
Um die durchschnittliche Atommasse von Kohlenstoff zu berechnen, brauchen wir ihre natürlichen Isotope mit ihren jeweiligen Häufigkeiten. Bei Kohlenstoff sind diese: 12C (98,89%) und 13C (1,11%). Die relativen Atommassen von ihnen sind 12 bzw. 13, was wiederum gleich 12 Uma und 13 Uma entspricht. Lösung:
Durchschnittliche Atommasse (c) = (12 Uma) (0,9889) + (13 Uma) (0,0111)
= 12.0111 Uma
Daher beträgt die Masse eines Kohlenstoffatoms im Durchschnitt 12,01 Uma. Beträge von Spuren von 14C, es hat fast keinen Einfluss auf diesen Durchschnitt.
Natrium
Alle terrestrischen Natriumatome bestehen aus dem Isotop 23Na, so ist seine Fülle 100% beträgt. Deshalb kann bei normalen Berechnungen angenommen werden, dass seine Masse einfach 23 UMA oder 23 g/mol beträgt. Die genaue Masse beträgt jedoch 22.98976928 Uma.
Sauerstoff
Die drei Sauerstoffisotope mit ihren jeweiligen Fülle sind: 16O (99.762%), 17Oder (0,038%) und 18O (0,2%). Wir haben alles, um seine durchschnittliche Atommasse zu berechnen:
Durchschnittliche Atommasse (O) = (16 Uma) (0,99762) + (17 Uma) (0,00038) + (18 Uma) (0,002)
= 16.00438 Uma
Obwohl die genaue Masse tatsächlich 15.9994 Uma beträgt.
Stickstoff
Wiederholen Sie dieselben Schritte mit Sauerstoff, den wir haben: 14N (99.634%) und fünfzehnN (0,366%). So:
Durchschnittliche Atommasse (n) = (14 Uma) (0,99634) + (15 Uma) (0,00366)
= 14.00366 Uma
Beachten Sie, dass die für Stickstoff gemeldete Masse 14.0067 Uma beträgt, etwas größer als das, was wir berechnen.
Chlor
Die Isotope von Chlor mit ihren jeweiligen Fülle sind: 35Cl (75,77%) und 37Cl (24,23%). Berechnung der durchschnittlichen Atommasse, die wir haben:
Durchschnittliche Atommasse (Cl) = (35 Uma) (0,7577) + (37 Uma) (0,2423)
= 35.4846 Uma
Sehr ähnlich dem Bericht (35.453 Uma).
Disposio
Und schließlich wird die durchschnittliche Masse eines Elements mit vielen natürlichen Isotopen berechnet: Disposio. Diese und mit ihren jeweiligen Häufigkeiten sind: 156DY (0,06%), 158DY (0,10%), 160DY (2,34%), 161DY (18,91%), 162DY (25,51%), 163DY (24,90%) und 164DY (28,18%).
Wir gehen wie in den vorherigen Beispielen fort, um die Atommasse dieses Metalls zu berechnen:
Durchschnittliche Atommasse (DY) = (156 Uma) (0,0006%) + (158 Uma) (0,0010) + (160 Uma) (0,0234) + (161 Uma) (0,1891) + (162 UMA) (0,2551) + (163 Uma) (0,2490) + (164 Uma) (0,2818)
= 162.5691 Uma
Die gemeldete Masse beträgt 162.500 Uma. Beachten Sie, dass dieser Durchschnitt zwischen 162 und 163 liegt, da die Isotope 156Dy, 158Dy und 160Dy sind nur wenige reichlich vorhanden; Während diejenigen, die vorherrschen, sind 162Dy, 163Dy und 164Dy.
Verweise
- Whitten, Davis, Peck & Stanley. (2008). Chemie. (8. Aufl.). Cengage Lernen.
- Wikipedia. (2019). Atommasse. Abgerufen von: in.Wikipedia.Org
- Christopher Masi. (S.F.). Atommasse. Erholt von: WSC.Masse.Edu
- Natalie Wolchover. (12. September 2017). Wie wägst du ein Atom an? Live -Wissenschaft. Erholt von: Livescience.com
- Chemistry Librettexts. (5. Juni 2019). Berechnung von Atommassen. Erholt von: Chem.Librettexts.Orks
- Edward Wichers und h. Steffen Peiser. (15. Dezember 2017). Atomares Gewicht. Encyclopædia Britannica. Erholt von: Britannica.com
- « Elektrokonvulsive Therapieeigenschaften, Effekte und Anwendungen
- Embryologiegeschichte, Studiengebiet und Zweige »

