Tunsen -Munder -Eigenschaften, Funktionen, Gebrauchsbeispiele

- 2909
- 368
- Joy Hort
Er Bunsen leichter Es handelt sich um ein Laborinstrument, das eine Wärmequelle effektiv und sicher durch eine Flamme liefern kann, die ein Produkt der Verbrennung eines Gass ist, das normalerweise Methan ist, oder einer Mischung aus Propan und Butan. Dieses Instrument selbst ist ein Synonym für Wissenschaft und Chemie.
Sein Name ist dem deutschen Chemiker Robert Bunsen, der zusammen mit dem Trainer Peter Desa verantwortlich war. Dieses Feuerzeug ist klein und Licht, sodass es praktisch an jeden Ort bewegt werden kann, an dem sich eine Gasflasche und optimale Verbindungen befinden.
 Bunsen leichter erhitzt die Lösung eines Kolbens. Quelle: Sally V/CC BY-SA (https: // createRecommons.Org/lizenzen/by-sa/4.0)
Bunsen leichter erhitzt die Lösung eines Kolbens. Quelle: Sally V/CC BY-SA (https: // createRecommons.Org/lizenzen/by-sa/4.0) Das Tunsen -Feuerzeug wird in Aktion gezeigt. Beachten Sie, dass das Szenario nicht einmal das eines Labors ist. Die Flamme, blau, erhitzt den Gehalt des Kolbens, um eine chemische Reaktion zu entwickeln oder einfach einen Feststoff schneller aufzulösen. Die Hauptverwendung dieses Instruments besteht daher darin, einfach eine Oberfläche, Probe oder ein Material zu erhitzen.
Das Bunsen -Feuerzeug wird jedoch auch für eine Vielzahl von Methoden und Prozessen wie Flammenversuch, Sterilisation, Destillation, Verbrennung und Zersetzung verwendet. Seit der Sekundarschulbildung war es die Ursache für Erstaunen und Ängste unter den Schülern, später ein Routineinstrument zu werden.
[TOC]
Geschichte
Die Ursprünge dieses ikonischen leichteren Date bis 1854 in einer der Labors der Universität von Heidelberg, wo Robert Bunsen arbeitete. Bis dahin hatten die Einrichtungen der Universität bereits ein rudimentäreres Gas- und leichteres Rohrsystem, mit dem sie Experimente durchführten.
Diese von Michael Faraday entworfenen Feuerzeuge erzeugten jedoch sehr helle und "schmutzige" Flammen, was bedeutet. Diese Flammen waren zusätzlich zur Tarnung der Farben, die bestimmte Substanzen beim Erhitzen befreit hatten, nicht heiß genug.
So beschloss Robert Bunsen zusammen mit dem deutschen Trainer Peter Drag, Verbesserungen in Faraday -Feuerzeugen umzusetzen. Um dies zu erreichen, suchten sie, dass das Gas mit einem höheren Luftfluss verbrannte, höher als derjenige, der sich frei im Labor befand. Auf diese Weise wurde das Bunsen-Disaga-Feuerzeug geboren.
Seitdem haben die Labors ein Feuerzeug zur Hand, das es Ihnen ermöglicht, eine viel heißere und "saubere" Flamme zu bekommen. Dank dieses Feuerzeugs wurden auch die Grundlagen oder Ursprünge der Spektroskopie festgelegt.
Kann Ihnen dienen: Carbonoide: Elemente, Eigenschaften und VerwendungEigenschaften und Teile des Tunsen leichter
- Instrument
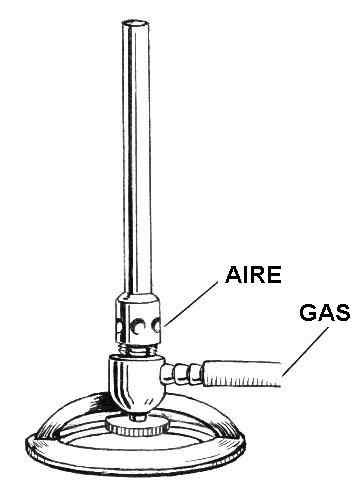 Zeichnung der Teile des Bunsen leichter. Quelle: Pearson Scott Foresman / Public Domain
Zeichnung der Teile des Bunsen leichter. Quelle: Pearson Scott Foresman / Public Domain In dem überlegenen Bild haben Sie eine Illustration des Tunsen -leichteren. Die jeweiligen Einträge sind sowohl für Luft als auch für Gas angegeben.
Das Gas verläuft in einem Gummischlauch vom Gashahn, der sich im selben Labornoll befindet, zum helleren Eingang. In der unteren Fläche des leichteren, knapp über dem von Ring geschnittenen Stütz.
Die Luft hingegen tritt durch die kreisförmigen (oder rechteckigen) Löcher seiner Halskette in das Feuerzeug ein. Wenn die Halskette gebrochen ist, fließt mehr Luft in die Löcher und mischen sich mit dem Gas. Diese Luft-Gas-Mischung steigt entlang des Laufs oder der Säule an, um schließlich durch die Düse des Feuerzeugs zu verlassen.
Alle leichter als Ganzes bestehen aus einem leichten Metall wie Aluminium, und seine Größe ist klein genug, um auf einem Regal oder einer Schublade aufbewahrt zu werden.
- Anrufe
Reduktor
 Die Flamme, die vom Bunsen -Feuerzeug erhalten wird. Quelle: Arthur Jankowski/CC BY-SA (http: // CreateRecommons.Org/lizenzen/by-sa/3.0/)
Die Flamme, die vom Bunsen -Feuerzeug erhalten wird. Quelle: Arthur Jankowski/CC BY-SA (http: // CreateRecommons.Org/lizenzen/by-sa/3.0/) Wenn eine Wärmequelle genau auf der Höhe der Düse des Feuerzeugs platziert wird, egal ob mit einem Lit oder einem Funken, verbrennt die Luftgasmischung und die Verbrennung beginnt. Es wird dann erscheinen, dann die Flamme. Die visuellen und chemischen Eigenschaften dieser Flamme hängen jedoch vom Aire-Gas-Verhältnis ab.
Wenn die Halskette geschlossen ist und die Luft zwischen ihren Löchern verhindert, gibt es ein gasreiches Gemisch, das mit dem Sauerstoff aus der umgebenden Luft verbrennt. Diese Flamme entspricht dem 1 (überlegenen Bild) und ist als die Flamme "sicher" und "schmutzig" bekannt, weil es am wenigsten heiß ist und die auch die größte Rußbetriebsmenge erzeugt. Beachten Sie, wie hell es ist und auch seine gelb-orangefarbenen Farben.
Die Leuchtkraft dieser Flamme ist auf die Tatsache zurückzuführen. Je offener der Gaseingang, desto größer wird diese Flamme sein.
Diese Flamme ist auch dafür bekannt.
Oxidationsmittel
Während sich die Halskette dreht, wird die Löcher, durch die die Luft geöffnet wird. Infolgedessen wird die gelbe Flamme immer bläulicher (von 2 bis 4), bis zu einem Punkt, an dem sie transparent erscheinen mag, wenn der Hintergrund und die Reinheit der Mischung zulassen.
Kann Ihnen dienen: Thermal: Struktur, Eigenschaften, Bildung, BeispieleDie Flamme 4 ist im Labor am meisten gewünscht und nützlich, da sie am heißesten ist und die Probe, die an Ihren Kontakt platziert wird. Aus diesem Grund ist diese Flamme durch Oxidationsmittel bekannt.
Funktionen/Verwendungen
 Leuchtung Tunsen leichter
Leuchtung Tunsen leichter Aus dem vorherigen Abschnitt kann der Schluss gezogen werden. Tatsächlich definiert es die jeweiligen Funktionen oder Verwendungen dieses Instrument.
Dies bedeutet jedoch nicht, dass es verwendet werden kann, um alles im Labor zu heizen. Zunächst muss der Schmelzpunkt des Materials über 1500 ° C liegen, maximale Temperatur, die die Flamme erreichen kann. Andernfalls würde es schmelzen und eine Katastrophe im Arbeitsinn verursachen.
Zweiten. Daher sollten nur Flüssigkeiten mit hohen Siedepunkten und niedriger Volatilität erhitzt werden.
Aus diesem Grund ist Wasser ein Beispiel für eine ideale Flüssigkeit, um durch die Verwendung von Bunsen leichter zu heizen. Zum Beispiel ist es normalerweise häufig, Destillationskugeln, Niederschlagsgefäße, Flaschen oder Töpfe mit wässrigen Lösungen zu erhitzen.
Beispiele verwenden
Verbrennung
Eine der Hauptanwendungen des Bunsen -Feuerzeugs besteht darin, eine Probe zur Verbrennung einzureichen. das heißt, oxidieren Sie es schnell und exotherm. Zu diesem Zweck wird die oxidative Flamme (blau und fast transparent) verwendet und die Probe wird in einem Behälter wie einem Schmelzen platziert.
Die meisten Proben bewegen sich jedoch anschließend zu einem MUFLA, wo Sie sich stundenlang weiter erhitzen können (auch für einen ganzen Tag).
Wärmeabzersetzung
Wie bei der Verbrennung, mit dem Bunsen leichter mit. Diese Methode erlaubt jedoch nicht, dass sie durch den Fortschritt der Zersetzung im Laufe der Zeit überwacht wird.
Kann Ihnen dienen: Dimethylanylin: Struktur, Eigenschaften, Synthese, verwendetFlammenprobe
Metallionen können durch Flammentests qualitativ nachgewiesen werden. Zu diesem Zweck wird ein zuvor erhitzter und untergetauchter Draht in Salzsäure mit der Probe in Kontakt gebracht und in die Flamme aufgenommen.
Die abgelösten Farben helfen dabei, das Vorhandensein von Metallen wie Kupfer (bläulich grün), Kalium (Violett), Natrium (intensives Gelb), Kalzium (orange Rot) usw. zu identifizieren.
Sterilisation von Materialien
Die Flammenwärme ist so, dass sie für einen weiteren genialen Gebrauch verwendet werden kann: Mikroorganismen auf der Oberfläche der Materialien zu zerstören. Dies ist besonders nützlich, wenn Sie mit Glas oder Metallen zu tun haben, die für Zwecke bestimmt sind, die eng mit der Gesundheit verbunden sind (Nadeln, Pipetten, Kopfhaut usw.).
Destillation
Es wurde zuvor gesagt, dass Wasser eine der Flüssigkeiten ist, die vorzugsweise mit dem Tunsen leichter erhitzt wurden. Aus diesem Grund wird es verwendet, um die Destillationskugeln zu erhitzen und so das Wasser so zu kochen, dass seine Dämpfe einige Essenzen oder Duftstoffe von Pflanzenmaterial ziehen (Orangenschalen, Zimtstaub usw.).
Andererseits kann es auch verwendet werden, um andere Arten von Gemischen zu destillieren, vorausgesetzt, die Intensität der Flamme wird moderiert und dabei zu viele Dämpfe erzeugt.
Bestimmung von Siedepunkten
Mit Hilfe des Thiele -Röhrchens, Öls, Stütze und Capilla. Dieses Experiment ist weit verbreitet, wenn Laboratorien der allgemeinen Chemie und der organischen Chemie unterrichtet werden.
Verweise
- Whitten, Davis, Peck & Stanley. (2008). Chemie. (8. Aufl.). Cengage Lernen.
- Wikipedia. (2020). Bunsenbrenner. Abgerufen von: in.Wikipedia.Org
- Zinseszins. (31. März 2016). Chemiegeschichte: Bunsen Burner Day. Erholt von: componentCeme.com
- Nikki Wyman. (31. August 2015). Bunsenbrenner: Teile, Funktion und Diagramm. Erholt von: Studium.com
- Nichols Lisa. (18. August 2019). Bunsenbrenner. Chemistry Librettexts. Erholt von: Chem.Librettexts.Org
- Wayne State University. (S.F.). Ordnungsgemäße Verwendung eines Bunsen -Brenners. [PDF]. Erholt von: Forschung.Wayne.Edu

