Die Hälfte der Grundlage, Vorbereitung, Verwendungen und Einschränkungen
- 4495
- 1140
- Rieke Scheer
Er Die Hälfte von oder Glucosefermentation ist ein semi-solides Agar.
Es wurde von Hugh und Leifson geschaffen; Diese Forscher erkannten, dass konventionelle Medien für die Untersuchung der Säureproduktion aus Kohlenhydraten für diese spezifische Gruppe von Bakterien nicht geeignet waren.
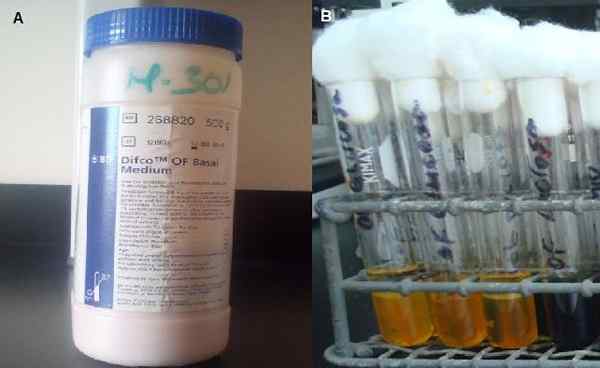
 ZU. Mitte des basalen Werbespots. B. Röhrchen mit der Hälfte des Soords. Quelle: A- und B -Fotos vom Autor MSC gemacht. Marielsa Gil.
ZU. Mitte des basalen Werbespots. B. Röhrchen mit der Hälfte des Soords. Quelle: A- und B -Fotos vom Autor MSC gemacht. Marielsa Gil. Dies liegt daran.
In diesem Sinne hat das Medium spezielle Eigenschaften, die die geringen Mengen an Säure erkennen können, sowohl durch oxidatives als auch durch fermentativ. Diese Unterschiede hängen mit der Menge an Peptonen, Kohlenhydraten und Agar zusammen.
Dieses Medium enthält weniger Peptonas und eine stärkere Konzentration von Kohlenhydraten. Auf diese Weise werden die Produkte, die das Medium Alkheat haben.
Andererseits begünstigt die Abnahme der Agarmenge die Verbreitung der vom gesamten Medium erzeugten Säure sowie die Beobachtung der Motilität.
Das Medium besteht aus Pepton, Natriumchlorid, Bromotimolblau, Dipotium -Phosphat, Agar und Kohlenhydrat. Das häufigste Kohlenhydrat ist Glukose, aber andere können gemäß dem, den Sie untersuchen möchten, wie Laktose, Maltose, Xylose unter anderem.
[TOC]
Basis
Wie jede Kulturmethode muss die Umwelt Ernährungssubstanzen enthalten, die ein Bakterienwachstum garantieren. Diese Substanzen sind peptones.
Kohlenhydrate liefert Energie und dient gleichzeitig dazu, das Verhalten des Mikroorganismus dagegen zu untersuchen, dh es ermöglicht es, die Bakterien als oxidativen, fermentativen oder nicht akkralen Organismus zu klassifizieren.
Das Medium von enthält ein Pepton/Kohlenhydrat -Verhältnis von 1: 5 im Gegensatz zu herkömmlichen Medien von 2: 1. Dies garantiert, dass die aus dem Abbau von Peptellen gebildete Menge an alkalischen Aminen die Bildung schwacher Säuren nicht neutralisiert.
Kann Ihnen dienen: Sphingomyeline: Was ist, Struktur, Funktionen, SyntheseAndererseits enthält das Medium Natriumchlorid und Dipotiumphosphat. Diese Verbindungen stabilisieren osmotisch in der Mitte und regulieren den pH -Wert. Bromootimol Blue ist der pH -Indikator, der die Farbe des Gelbgrüns durch die Herstellung von Säure macht.
Einige Mikroorganismen können Kohlenhydrate durch oxidativ oder auf dem fermentativen Weg verwenden, während andere keiner so eingehen.
Dies hängt von der Eigenschaft jedes Mikroorganismus ab. Beispielsweise können einige strenge aerobe Mikroorganismen bestimmte Kohlenhydrate oxidieren, und optionale Anaerobes können je nach Umgebung, die sie umgibt, oxidieren und fermentieren, während andere Kohlenhydrate nicht oxidieren oder fermentieren (Ascarolitik).
Schließlich gibt es eine Modifikation des von der CDC empfohlenen Mediums, das eine spezielle Basis von rotem Phenol als Indikator enthält.
Oxidationsprozess
Der Glukoseoxidationsprozess erfordert keine Glukosephosphorylierung, wie im Fermentationsprozess auftritt. In diesem Fall wird die Aldehydgruppe zu einer Carboxylgruppe oxidiert, was zu Gluconsäure führt. Dies wiederum wird auf 2-Zo-Glyconic oxidiert.
Letztere oder zwei Pyruvinsäuremoleküle akkumulieren oder degradieren. Dieses System braucht das Vorhandensein von Sauerstoff oder einer anorganischen Verbindung als endgültiger Elektronenakzeptor.
Die Produktion von Säuren auf dieser Route ist schwächer als die, die durch den fermentativen Weg erhalten wurde.
Fermentationsprozess
Um die Glukosefermentation durch eine der verfügbaren Straßen zu machen, muss sie zunächst phosphoryliert werden und werden Glukose-6-Phosphat.
Die Glukosefermentation kann mehrere Straßen dauern, der Hauptweg ist der Weg von Embden-Meyerhof-Parna des Abbaus von Pentose.
Der gewählte Pfad hängt vom enzymatischen System ab, das den Mikroorganismus besitzt.
Über de embden-Meyerhof-Parna
In der Fermentation von Glucose durch Embden-Meyerhof-Parna. Von dort aus entsteht eine Zwischensubstanz, die Pyruvsäure ist.
Kann Ihnen dienen: PhotoperiodeVon dort aus werden verschiedene Arten von gemischten Säuren gebildet, die von einer Spezies zu einer anderen variieren können.
Dieses System tritt in Abwesenheit von Sauerstoff auf und benötigt eine organische Verbindung als endgültiger Elektronenakzeptor.
OCOUDOROFF -Route
Bei der Fermentation von Glucose durch den Intner-Doucoroff-Weg geht das Glucose 6-phosphat in Glucon-ᵼ-Lacton-6-phosphat und von dort aus oxidiert auf 6-phosphogluvat und 2-ZO-3-DEDEXI-6-Phosphogluconat,, endlich Pyruvinsäure bilden. Dies braucht über Sauerstoff, so dass es Glykolyse gibt.
Route zum Abbau der Pentose- oder Warburg-Dikens-Monophosphatmonophosphat über
Diese Route ist eine Mischung der vorherigen 2. Es beginnt ähnlich wie der Entner-Doudoroff-Weg, aber anschließend wird Glyceraldehyd-3-phosphat als Pyruvinsäure-Vorläufer gebildet, wie es im Weg von Embden-Meyerhof-Parna der Fall ist.
Vorbereitung
Wiegen:
2 g Pepton
5 g Natriumchlorid
10 g D-Glucosa (oder Kohlenhydrat, die vorbereitet sein werden)
0,03 g Bromotimolblau
3 g Agar
0,30 g dipotasisches Phosphat
1 Liter destilliertes Wasser.
Mischen Sie alle Verbindungen mit Ausnahme von Kohlenhydraten und löst sich in 1 Liter destilliertem Wasser auf. Erhitzen und rühren, bis sie sich in seiner Gesamtheit auflösen.
Beim Abkühlen bei 50 ° C werden 100 ml Glukose zu 10% zugesetzt (gefiltert).
Verbreiten Sie aseptisch 5 ml des Mediums in Testrohre mit Baumwolldeckel und Autoklavieren bei 121 ° C, 15 Pfund Druck für 15 Minuten.
Vertikale Position hereinlassen.
Der mittlere pH muss 7, 1 sein. Die Farbe des vorbereiteten Mediums ist grün.
Im Kühlschrank behalten.
Anwendungen
Das Medium ist ein besonderes Mittel, um das Stoffwechselverhalten eines Mikroorganismus gegen einen Kohlenhydrat zu bestimmen. Besonders für diejenigen, die seltene, schwache oder nullweise Säuren bilden.
Gesät
Für jeden Mikroorganismus müssen 2 Röhrchen benötigt werden, beide müssen mit dem Mikroorganismus untersucht werden, um zu untersuchen. Die Kolonie wird mit einem geraden Griff genommen und in der Mitte des Röhrchens eine Punktion hergestellt, ohne den Boden zu erreichen. Sie können mehrere Punktionen vornehmen, solange Sie nicht daran interessiert sind, die Motilität zu beobachten.
Kann Ihnen dienen: Alanin: Eigenschaften, Struktur, Funktionen, BiosyntheseZu einem der Röhrchen wird eine Schicht steriler Flüssigkeitsvaseline oder sterilem geschmolzenes Paraffin (ungefähr 1 bis 2 ml) zugegeben und mit dem Buchstaben "F" markiert. Das andere Röhrchen wird original gelassen und mit dem Buchstaben "O" gekennzeichnet. Beide Röhrchen werden bei 35 ° C inkubiert und werden täglich bis zu 3 bis 4 Tage beobachtet.
Deutung
Gasstoffwechsel und Produktion
Tabelle: Klassifizierung von Mikroorganismen gemäß ihrem Verhalten im offenen (oxidativen) und geschlossenen (fermentativen) Röhrchen (fermentativ)
 Quelle: Hergestellt vom MSC -Autor. Marielsa Gil
Quelle: Hergestellt vom MSC -Autor. Marielsa Gil Das Gas wird mit der Bildung von Blasen oder Verschiebung des Agars beobachtet.
Es ist zu beachten, dass ein Organismus, der nur Glukose, aber nicht fermentiert, andere Kohlenhydrate nicht fermentieren kann, auf jeden Fall nur oxidieren. Daher wird in dieser Situation das versiegelte Rohr für die Untersuchung anderer Kohlenhydrate weggelassen.
Motilität
Darüber hinaus ist in der Mitte der Motilität zu sehen.
Positive Motilität: Wachstum, das nicht auf die Inokulationszone beschränkt ist. Es gibt Wachstum zu den Seiten des Rohrs.
Negative Motilität: Wachstum nur im anfänglichen Inokulum.
QA
Als Qualitätskontrolle können Sie die folgenden Stämme verwenden: Escherichia coli, Pseudomonas aeruginosa Und Moraxella sp. Die erwarteten Ergebnisse sind:
- coli: Glukosefermenter (sowohl Gelb- als auch Gasrohre).
- aeruginosa: Glukoseoxidader (gelbe offenes Rohr und grünes oder blaues Siegel).
- Moraxella sp: Nicht -Removal (grünes oder blaues offenes Rohr, grünes Dichtungsrohr).
Einschränkungen
-Einige Mikroorganismen können nicht in der Umwelt von wachsen. In diesen Fällen wird der Test wiederholt, aber auf das Medium 2% Serum oder 0,1% Hefeextrakt.
-Oxidationsreaktionen werden häufig nahe an der Oberfläche beobachtet und der Rest des Mediums kann grün sein, genauso wie es als positiv angesehen wird.
Verweise
- Koneman E, Allen S., Janda W., Schreckenberger P., Winn W. (2004). Mikrobiologische Diagnose. 5. ed. Pan -American Editorial s.ZU. Argentinien.
- Forbes B, Sahm D, Weissfeld A. (2009). Mikrobiologische Diagnose von Bailey & Scott. 12 ed. Pan -American Editorial s.ZU. Argentinien.
- Mac Faddin J. (2003). Biochemische Tests zur Identifizierung klinischer Bedeutung Bakterien. 3. Aufl. Pan -American Editorial. Buenos Aires. Argentinien.
- Labors Francisco Soria Melguizo. 2009. Von Glukosemedium. Verfügbar unter: http: // f-soria.Ist
- Conda Pronadisa Laboratorien. Mitten in Glukose. Erhältlich bei: Condalab.com
- BD Laboratories. 2007. Von basalem Medium. Verfügbar bei: BD.com

