Alkalische Metalle Physikalische und chemische Eigenschaften, Verwendungen, Erhalten
- 992
- 280
- Nick Laurén
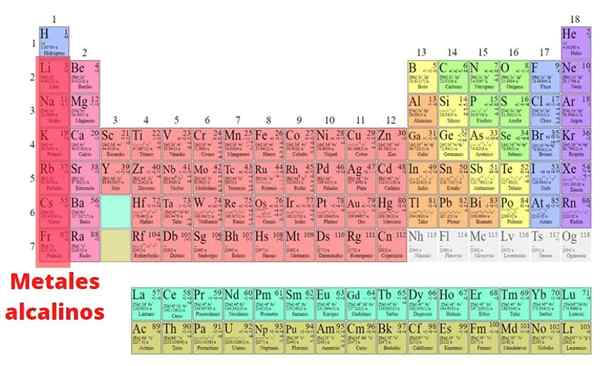
Der Alkali Metalle Dies sind die Elemente, die Teil der Gruppe I des Periodensystems sind, außer Wasserstoff: Lithium (LI), Natrium (Na), Kalium (K), Rubidid. Im Gegensatz zu den meisten Metallen haben sie niedrige Dichten und sind sehr reaktiv. Aufgrund dieser großen chemischen Reaktivität werden sie in ihrer elementaren Form nie in der Natur gefunden.
Diese Metalle bilden einfache und stabile ionische Verbindungen, die größtenteils in Wasser löslich sind; Alkalische Metalle werden normalerweise mit Halogenid-, Sulfat-, Carbonat- und Silikationen kombiniert. Einige Elemente bilden jedoch eine begrenzte Anzahl komplexer und organomethalischer Verbindungen.

Im Allgemeinen wurden die physikalischen und chemischen Eigenschaften von alkalischen Metallen aufgrund seiner radioaktiven Natur mit Ausnahme von Francio gut untersucht.
[TOC]
Physikalische Eigenschaften
- Alkalische Metalle sind Silber, außer Cäsium, das golden ist. Sie leiten Elektrizität und Wärme und haben niedrige Schmelzpunkte, die ebenfalls mit der Zunahme der Atomzahl abnehmen, da die Verbindung zwischen Atomen durch Erhöhung des Atomradius geschwächt wird.
- Die Tatsache, nur ein Elektron Valencia durch Atom zu haben, macht seine Metallbindung auch schwach. Folglich sind alkalische Metalle auch weich genug, um sie mit einem Messer oder einem Spatel zu schneiden.
- Alle Elemente verwenden eine Kubikstruktur, die sich auf den Körper konzentriert. Da diese Art der kristallinen Struktur nicht verpackt ist und die atomaren Radios von alkalischen Metallen groß sind, haben sie im Vergleich zu anderen Metallen niedrige Dichten. Tatsächlich schweben Lithium, Natrium und Kalium im Wasser.
- Energieunterschiede zwischen den Orbitalen der Valencia -Schicht alkalischer Metalle stimmen mit Wellenlängen des sichtbaren Lichts zusammen. Aus diesem Grund werden beim Erhitzen der von diesen Metallen in einer Flamme gebildeten Verbindungen charakteristische Farben erzeugt.
Es kann Ihnen dienen: Trinitrotolueno (TNT): Struktur, Eigenschaften, Verwendung, Risiken, Explosion- In absteigender Reihenfolge verleihen Lithiumsalze eine purpurrote Farbe, Natriumsalze eine gelbe Farbe, Kalium eine violette Farbe, Rubidium eine bläuliche rote Farbe und aufhören eine blaue Farbe auf.
Chemische Eigenschaften
Alle alkalischen Metalle haben Ähnlichkeiten in ihren chemischen Eigenschaften.
- Sie haben eine elektronische Konfiguration von Valencia NS1, die in einen Oxidationszustand +1 führt. Dies bedeutet wiederum, dass sie leicht ein Elektron verlieren, um eine Edelgaskonfiguration zu erreichen.
- Im Allgemeinen haben alkalische Metalle die niedrigsten Ionisationsenergien aller Elemente, was auch abnimmt, wenn der Atomradius innerhalb der Gruppe zunimmt, da die Valencia -Schicht zunehmend vom Kern entfernt ist. Dies erklärt die Reaktivität von alkalischen Metallen und die Bildung von M+ -Ionen unter leicht wässrigen Bedingungen.
- Die thermodynamische Tendenz zur Bildung von M+ -Ionen wird durch die Standardpotentiale von M+/M -Paaren bestätigt, die alle groß und negativ sind. Ein solcher Trend impliziert, dass alkalische Metalle leicht oxidieren und als leistungsstarke reduzierende Wirkstoffe wirken können.
- Diese Elemente müssen in einem nicht reaktiven Öl gespeichert werden, um eine Reaktion mit atmosphärischem Sauerstoff zu vermeiden. Obwohl Lithium, Natrium und Kalium für kurze Zeit in der Luft manipuliert werden können, müssen Rubidium und Cäsium jederzeit unter einer inerten Atmosphäre behandelt werden.
Alkal -Metalle erhalten
Natrium

Der beste Weg, um metallisches Natrium zu erhalten. Da der Schmelzpunkt des Natriumchlorids ziemlich hoch ist (808 ° C) und viel Energie erforderlich ist, um große Mengen der geschmolzenen Substanz aufrechtzuerhalten, wird Calciumchlorid (CACL2) normalerweise zugesetzt, um den Schmelzpunkt auf etwa 600 ° C zu reduzieren.
Kann Ihnen dienen: TurbidimetrieNatrium wird in einem flüssigen Zustand in der Kathode mit einer Reinheit von 99,95% unter einer inerten Atmosphäre erhalten.
Lithium und Kalium
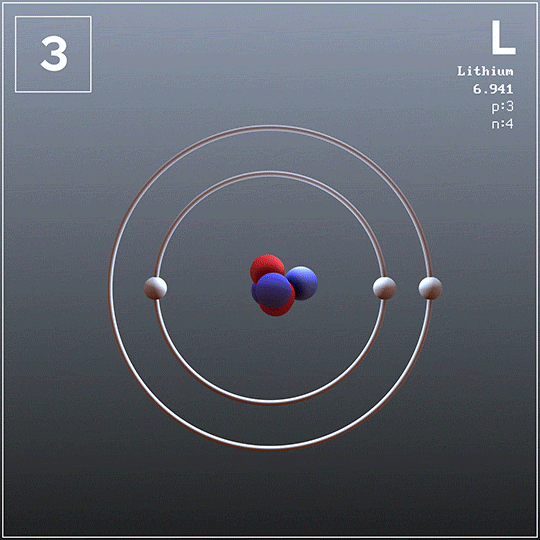
Lithium kann auch aus seinen Chloriden gewonnen werden. Darüber hinaus verdampft es leicht zur Betriebstemperatur, so dass es gefährliche Bedingungen erzeugt.
Daher wird Kalium durch Reduktion von geschmolzenem KCl mit flüssigem Natrium erhalten. Das in Kalium vorhandene Natrium wird durch Kondensat des Dampfes bei 892 ° C und durch die Durchführung einer fraktionierten Destillation von Flüssigkeitsmetallen eliminiert.
Rubidio und Cesio
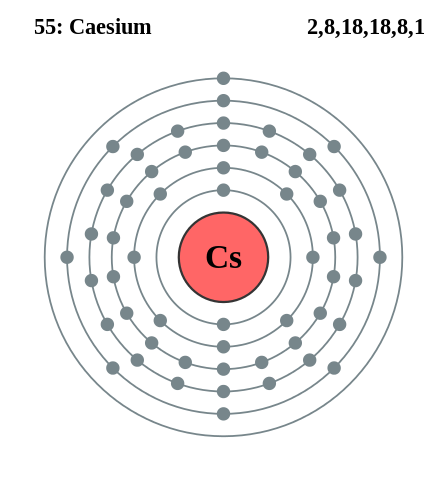 Elektronische Cäsiumkonfiguration. Quelle: Pumbaa (Originalarbeit von Greg Robson) / CC BY-SA 2.0 UK (https: // creativeCommons.Org/lizenzen/by-sa/2.0/UK/Tat.In)
Elektronische Cäsiumkonfiguration. Quelle: Pumbaa (Originalarbeit von Greg Robson) / CC BY-SA 2.0 UK (https: // creativeCommons.Org/lizenzen/by-sa/2.0/UK/Tat.In) Rubidio und Cäsium können ähnlich erhalten werden, jedoch mit Calcium als Reduktionsmittel. Metallic Cesium kann auch durch geschmolzene Cäsium -Cyanidelektrolyse (CSCN) erhalten werden.
Hauptnutzungen und Anwendungen
Natrium als Reduktionsmittel
Da Natrium sehr leicht oxidiert wird, ist die wichtigste Anwendung ein Reduktionsmittel, um Metalle wie Titan, Surround und Hafnio zu erhalten. Es wird auch als Wärmetauscher in Kernreaktoren in seinem flüssigen Zustand verwendet.
Kalium als Dünger
 Kaliumchlorid, Dünger. Quelle: Abbas cucaniensis/CC BY-SA (https: // createRecommons.Org/lizenzen/by-sa/4.0)
Kaliumchlorid, Dünger. Quelle: Abbas cucaniensis/CC BY-SA (https: // createRecommons.Org/lizenzen/by-sa/4.0) Der größte Teil des verarbeiteten Kaliums geht an Düngemittel in Form von Kaliumchlorid. Chlorid wird wiederum bei der Herstellung anderer Verbindungen und Lösungen wie Kaliumhydroxid verwendet, die bei der Herstellung von Flüssigseifen verwendet werden.
Kaliumcyanid wird für die Metallentnahme oder -beschichtung verwendet, um Kupfer-, Silber- und Goldabscheidung zu erleichtern. Kalium kann auch in einigen Sprengstoffen und als Feuerwerkskörper gefunden werden.
Kann Ihnen dienen: Radio: Struktur, Eigenschaften, Verwendungen, ErhaltenLithium als Legierungsvertreter
Metallic Lithium wird als Legierungsmittel bei der Herstellung von Aluminium- und Magnesium -Luft- und Luft- und Raumfahrtlegierungen verwendet. Im Laufe der Zeit hat es jedoch zunehmend Nützlichkeit als alkalische Batterieanode festgestellt.
Metallic Lithium ermöglicht es auch, die Schmelz- und Sintertemperaturen bestimmter Arten von Glas und Keramik zu verringern und den Expansionskoeffizienten zu verringern. Lithiumcarbonat wird häufig zur Behandlung von bipolaren Erkrankungen eingesetzt, während Lithiumstearat ein Schmiermittel ist, das in der Automobilindustrie weit verbreitet ist.
Rubidio und Cesio
Rubidio und Cäsium werden normalerweise in denselben Anwendungen verwendet, sodass eines dieser Elemente durch das andere ersetzt werden kann. Zu den Anwendungen gehören Glasfaserglas in der Telekommunikationsbranche, Nachtsichtausrüstung und photoelektrische Zellen. Die Cesio -Uhr (Atomuhr) wird für das internationale Standardzeitmaß und für die Definition des zweiten verwendet.
Verweise
- Chang, R., & Goldsby, K. ZU. (2016). Chemie (12. Aufl.). New York: Mc-Grea-Hügel.
- Halka, m., & Nordstrom, b. (2010). Alkali und alkalische Erdmetalle. New York: Infobase Publishing.
- Miesler, g. L., Fischer, p. J., & Tarr, D. ZU. (2014). Anorganische Chemie (5. Aufl.). New York: Pearson.
- Mishra, geb., & Majumdar, g. (2017). Alkali -Metallproduktion (Li, Na, K). Referenzmodul in der Materialwissenschaft und Materialtechnik. Elsevier.
- Petrucci, r. H., Hering, f. G., Bissonnette, c., & Reifen, j. D. (2017). Allgemeine Chemie: Prinzipien und moderne Anwendungen (11. Aufl.). New York: Pearson.
- Shriver, d., Weller, m., Overton, t., Rourke, J., & Armstrong, f. (2014). Anorganische Chemie (6. Aufl.). New York: W. H. Freeman.
- « Auf welchem Kontinent gibt es eine größere Bevölkerungskonzentration?
- Eigenschaften, Perioden, Werkzeuge und Erfindungen der Bronzezeit »

