Metilaminstruktur, Eigenschaften, Produktion, verwendet
- 3158
- 306
- Tizian Liebich
Der Metilamin Es ist eine organische Verbindung, deren kondensierte Formel Cho ist3NH2. Insbesondere ist es das einfachste primäre Alkyamin von allen, da es nur einen alquilischen Substituenten enthält, der das gleiche ist wie zu sagen.
Unter normalen Bedingungen ist es ein Ammoniakgas, das nach Fisch riecht, aber relativ leicht zu kondensieren und in hermetischen Panzern zu transportieren ist. Ebenso kann es in Wasser merklich gelöst werden, was gelbliche Lösungen verursacht. Andererseits kann es auch als fest in Form Ihres Hydrochloridsalzes CH transportiert werden3NH2· HCl.
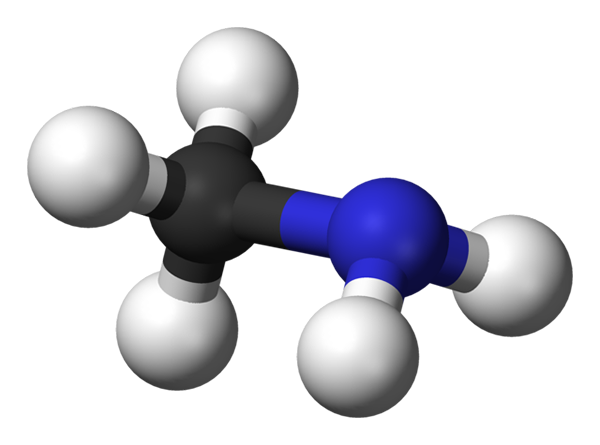
 Metilaminmolekül. Quelle: Benjah-BMM27 über Wikipedia.
Metilaminmolekül. Quelle: Benjah-BMM27 über Wikipedia. Metilamin kommt industriell aus Ammoniak und Methanol auf, obwohl es auf Laborskalen viele andere Produktionsmethoden gibt. Sein Gas ist sehr explosiv, daher hat jede Wärmequelle in der Nähe das Potenzial, ein großes Feuer zu verursachen.
Es ist eine Verbindung mit hoher kommerzieller Nachfrage, aber gleichzeitig stellt sie starke rechtliche Beschränkungen dar, da sie als Rohstoff für Drogen und psychotrope Substanzen dient.
[TOC]
Struktur
Das obige Bild zeigt die molekulare Struktur des Methylamin, das durch ein Modell von Kugeln und Balken dargestellt wird. Die schwarze Kugel entspricht dem Kohlenstoffatom, dem Blau zum Stickstoffatom und dem Weiß zu den Wasserstoffatomen. Es ist daher ein kleines Molekül, in dem Methan, Cho4, Verlieren Sie ein H für eine NH -Gruppe2, Ch3NH2.
Metilamin ist ein hochpolares Molekül, da Stickstoffatom elektronische Kohlenstoffdichte und Wasserstoffatome anzieht. Es hat die Fähigkeit, auch Wasserstoffbrücken zwischen dem Kompendium seiner intermolekularen Kräfte zu bilden. Jedes Molekül von CH3NH2 Sie können eine aufeinanderfolgende Wasserstoffbrücke spenden oder akzeptieren (CH3Hnh-nh2CH3).
Kann dir dienen: Was ist die Bandtheorie??Die molekulare Masse ist jedoch zusätzlich zu den Ports CH erheblich niedrig3 Sie behindern solche Wasserstoffbrücken. Das Ergebnis ist, dass Methylamin unter normalen Bedingungen ein Gas ist, das jedoch bei einer Temperatur von -6 ºC kondensiert werden kann. Beim Kristallisieren folgt dies einer ortorrombischen Struktur.
Eigenschaften
Aussehen
Buntes Gas oder Flüssigkeit, der jedoch wässrige Lösungen gelbliche Töne aufweisen können.
Geruch
Unangenehm, ähnlich der einer Mischung aus Fisch und Ammoniak.
Molmasse
31.058 g/mol
Schmelzpunkt
-93.10 ºC
Siedepunkt
Um die -6 ºC. Daher ist es ein Gas, das bei nicht zu kalten Temperaturen kondensieren kann.
Dichte
656,2 kg/m3 bei 25 ºC. Seine Dämpfe sind 1,1 -mal dicht als Luft, während sein Flüssigkeit oder sein Kondensat etwa 0,89 -mal weniger dicht sind als Wasser.
Dampfdruck
Bei Raumtemperatur reicht Ihr Dampfdruck 3,5 atm.
Dipolarem Moment
1,31 d
Wasserlöslichkeit
1.080 g/l bei 20 ºC. Es ist ein Gas, das sich im Wasser sehr gut auflöst, da beide Moleküle polar sind und bei der Einrichtung von Wasserstoffbrücken miteinander verbunden sind3Hnh-oh2).
Basizität
Metilamin hat eine Basizitätskonstante (PKB) von 3,36. Dieser Wert zeigt an, dass es sich um eine wesentlich grundlegende Substanz handelt, sogar mehr als das gleiche Ammoniak. Daher löst sie sich in Wasser auf eine bestimmte Anzahl von OH -Ionen frei- Bei hydrolyzisierter:
CH3NH2 + H2Oder ⇌ ch3NH3+ + Oh-
Metilamin ist grundlegender als Ammoniak, da sein Stickstoffatom eine größere elektronische Dichte aufweist. Das liegt daran, dass Cho3 Mehr Stickstoffelektronen gemacht als die drei Wasserstoffatome im NH -Molekül3. Trotzdem wird Methyilamin als schwache Basis vor anderen Alkyaminen oder Aminen angesehen.
Kann Ihnen dienen: CO2 -Link -TypFlammpunkt
-10 ºC zu einer geschlossenen Tasse, was bedeutet, dass es sich um ein hochflammbares und gefährliches Gas handelt.
Selbstdirektionstemperatur
430 ºC
Oberflächenspannung
19,15 Mn/m A 25 ºC
Zersetzung
Beim Verbrennen wird es thermisch in Kohlenstoff- und Stickoxiden zersetzt, die einen giftigen Rauch bilden.
Produktion
Metilamin kann entweder nach der kommerziellen oder industriellen Methode oder nach Labormethoden auf niedrigeren Skalen hergestellt oder synthetisiert werden.
Industriell
Metilamin tritt industriell durch die Reaktion auf, die zwischen Ammoniak und Methanol auf einer katalytischen sympathischen Gelunterstützung stattfindet. Die chemische Gleichung für diese Reaktion lautet wie folgt:
CH3OH + NH3 → Ch3NH2 + H2ENTWEDER
Dabei können andere Alkamine erzeugt werden; Methyilamin ist jedoch das Produkt, das kellenetisch bevorzugen aussieht.
Labor
Auf Laborebene gibt es verschiedene Methoden, die es ermöglichen, kleine Methylamin mit kleinem Gewalt zu synthetisieren. Eine von ihnen ist die Reaktion in einem starken Grundmedium von KOH zwischen Acetamid und Brom, bei dem Methylisozianat erzeugt wird, CH3NCO, was wiederum hydrolysiert wird, um Methylierung zu werden.
Metilamin kann als Feststoff aufbewahrt werden, wenn sie mit Salzsäure neutralisiert werden, so dass sich eine Hydrochloridsalz bildet:
CH3NH2 + HCl → Ch3NH2· HCl
Dann Methylaminhydrochlorid, ebenfalls als [CH) dargestellt3NH3] Cl, kann auf einem sicheren Ort basieren, um die wässrige Lösung mit gelöstem Gas zu erhalten:
[CH3NH3] Cl + naoh → ch3NH2 + NaCl + H2ENTWEDER
Andererseits kann Methylamin auch aus Hexamin synthetisiert werden (CH2)6N4, das direkt mit Salzsäure hydrolysiert:
Kann Ihnen dienen: Kristallisation(CH2)6N4 + HCl + 6 h2O → 4 NH4CL + 6 CH2ENTWEDER
Nachfolgend reagiert Ammoniumchlorid mit heißem Formaldehyd, um Methyilamin- und Ameisensäuredämpfe zu verursachen, HCOOH.
Außerdem kann Methylamin durch Reduzieren von Nitromethan, CH erhalten werden3NEIN2 mit metallischem Zink und Salzsäure.
Anwendungen
 Ephedrine ist ein Medikament, das Methyilamin für die kommerzielle Produktion benötigt. Quelle: Turkeyphant.
Ephedrine ist ein Medikament, das Methyilamin für die kommerzielle Produktion benötigt. Quelle: Turkeyphant. Metilamin ist eine Verbindung, deren Verwendungen normalerweise Kontroversen erzeugen, da es sich um eine Substanz handelt, die in der Narkotiksynthese wie Methamphetamin verwendet wird. Tatsächlich ist seine Popularität auf den Wunsch zurückzuführen, dass die Protagonisten der Breaking Bad -Fernsehserie es um jeden Preis bekommen mussten.
Diese Verbindung wird auch als Rohstoff für die Herstellung von Insektiziden, Medikamenten, Tensiden, Sprengstoff, Farbstoffen, Fungiziden, Zusatzstoffen usw. verwendet., Es hat also eine starke Weltnachfrage, zusätzlich zu mehreren rechtlichen Beschränkungen für den Erwerb.
Seine immense Chemie Vielseitigkeit ist auf sein CHO -Molekül zurückzuführen3NH2 Es handelt. Dies basiert beispielsweise auf der Synthese des Ephedrine, wo Cho3NH2 Es verbindet ein Molekül mit dem daraus resultierenden Verlust von a h.
Verweise
- Morrison, r. T. und Boyd, r, n. (1987). Organische Chemie. 5. Ausgabe. Editorial Addison-Wesley Interamerikaner.
- Carey f. (2008). Organische Chemie. (Sechste Ausgabe). Mc Graw Hill.
- Graham Solomons t.W., Craig b. Braten. (2011). Organische Chemie. (10. Ausgabe.). Wiley Plus.
- Wikipedia. (2020). Methylamin. Abgerufen von: in.Wikipedia.Org
- Nationales Zentrum für Biotechnologie Information. (2020). Methylamin. Pubchem -Datenbank., CID = 6329. Erholt von: Pubchem.NCBI.NLM.NIH.Regierung
- Dylan Matthews. (15. August 2013). Hier ist, was "Breaking Bad" über das Meth -Geschäft richtig und falsch wird. Erholt von: Washingtonpost.com
- Primchem. (2020). Herstellung von Methylaminhydrochlorid. Erholt von: Primchem.com
- « Nitrileigenschaften, Nomenklatur, Verwendungen, Beispiele
- Politische Organisation der Azteken der Macht »

