Metionineigenschaften, Funktionen, Lebensmittel, Vorteile

- 2979
- 500
- Joe Hartwig
Der Metionin (MET, M) ist eine Aminosäure, die innerhalb der Gruppe von hydrophoben oder apolaren Aminosäuren klassifiziert ist. Diese Aminosäure enthält Schwefel in ihrer Seitenkette, die mit Metallatomen oder elektrophilen Gruppen reagieren kann.
Metionine wurde von John Howard Mueller im zweiten Jahrzehnt des 20. Jahrhunderts entdeckt. Mueller isolierte das Methode von Casein, ein Protein, das er für das Wachstum von hämolytischen Streptokokkenpflanzen verwendete.
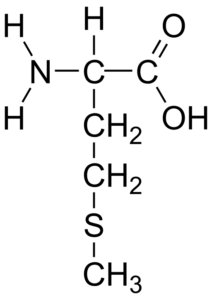 Chemische Struktur von Aminosäuremetionin (Quelle: HBF878 [CC0] über Wikimedia Commons)
Chemische Struktur von Aminosäuremetionin (Quelle: HBF878 [CC0] über Wikimedia Commons) Der Name "Metionin" ist eine Abkürzung des chemischen Namens dieser Aminosäure: γ-methyl-α-Aminobutinsäure und wurde von s eingeführt. Odake im Jahr 1925.
Es handelt. Pflanzen und Bakterien synthetisieren aus Homocystein, einem Derivat von Cystein und Homoserin.
Sein Katabolismus impliziert einerseits die Eliminierung von Stickstoff aus seiner Struktur und Ausscheidung als Harnstoff und andererseits die Umwandlung seiner kohlensäurehaltigen Kette in Succinyl CoA.
Zusammen mit dem Valin und dem Treonin wird Metionin als glykogene Aminosäure angesehen, da diese Aminosäuren Succinat werden und in den Krebszyklus gelangen können. Glykogene Aminosäuren können Kohlenhydrate und damit Glukose verursachen.
Es gibt viele Lebensmittel wie Thunfisch, Fleisch, Eiweiß, Käse und Nüsse.
Metionin ist für die Synthese vieler Proteine wesentlich, es erfüllt wichtige Funktionen im Fettstoffwechsel, hauptsächlich für den Skelettmuskel, und nimmt auch als Antioxidans teil.
Es gibt zahlreich. Einige induzieren die Akkumulation von Homocystein, das von Thrombose, Veränderungen des Zentralnervensystems (ZNS), schwerwiegender geistiger Behinderung und Skelettsystem begleitet wird.
Andere, wie das Fehlen von Adenosyltransferase, das das erste Enzym ist, das beim Abbau des Methodins wirkt.
[TOC]
Eigenschaften
Metionin ist eine essentielle Aminosäure, die weder vom menschlichen Körper noch von vielen erzeugt wird. Dies ist ein ausgezeichnetes Antioxidans und eine Schwefelquelle für unseren Körper.
Der tägliche Metioninanforderungen für Säuglinge beträgt 45 mg/Tag, bei Kindern 800 mg/Tag und bei Erwachsenen zwischen 350 und 1.100 mg/Tag.
Metionin ist eine der Hauptquellen für den Schwefel des Organismus; Schwefel ist ein grundlegender Bestandteil einiger Vitamine wie Thiamin oder Vitamin B1, einiger Hormone wie Glucagon, Insulin und einigen Hypophysenhormonen.
Es ist in Keratin, einem Hautprotein, Nägeln und Haaren, und es ist auch wichtig für die Kollagen- und Kreatin -Synthese. Daher hängt von Methoden, die die Schwefelquelle ist, mit allen Funktionen von Schwefel oder organischen Substanzen zusammen, die sie enthalten.
Struktur
Die chemische Formel von Metionin ist H2CCH (NH2) CH2CH2SCH3 und seine molekulare Formel ist C5H11NO2s. Es ist eine essentielle hydrophobe Aminosäure, die in apolare Aminosäuren eingeteilt ist.
Es verfügt über einen α-Kohlenstoff, der an eine Amino-Gruppe (-nh2), eine Carboxylgruppe (-coh), an ein Wasserstoffatom und eine Seitenkette (-r), die Schwefel enthält und wie folgt konstituiert ist S-CH3.
Kann Ihnen dienen: Die 12 Stufen der menschlichen Entwicklung und deren MerkmaleAlle Aminosäuren, mit Ausnahme von Glycin, können als Enantiomere in L o d existieren, so dass es möglicherweise L-Methionin und D-Methionin gibt. In der Struktur von Zellproteinen befindet sich jedoch nur L-Methionin.
Diese Aminosäure hat einige Dissoziationskonstanten PK 1 von 2.28 und PK2 von 9.21 und ein isoelektrischer Punkt von 5.8.
Funktionen
Metionin ist eine essentielle Aminosäure für die Synthese vieler Proteine, darunter einige Hormone, die Proteine, die Haut, Haare und Nägel bilden, usw.
Es wird als natürliches Entspannungsmittel für den Schlaf verwendet und ist sehr wichtig für den guten Zustand der Nägel, der Haut und des Haares. Verhindert einige Leber- und Herzerkrankungen; Vermeiden Sie die Akkumulation von Fetten in den Arterien und ist für die Synthese von Cystein und Stierkampf unverzichtbar.
Es bevorzugt die Verwendung von Fetten als Energie und Intervenien in den Transport und die Verwendung von ihnen, insbesondere im Skelettmuskel, daher ist es für Muskelübung sehr wichtig.
Histaminspiegel reduzieren. Es ist ein natürliches Antioxidans, da es dazu beiträgt, freie Radikale zu reduzieren. Es hat auch antidepressive und anxiolytische Eigenschaften.
Eine weitere kürzlich durchgeführte Verwendung von Metionin als "Radio" für die bildologische Studie in Positronenemissionstomographien (PET) im Bereich der Neuro-Arnkologie.
Es hat auch eine umfangreiche Verwendung als Funkkontest für Gliome, sowohl im Prozess der Planung chirurgischer Extraktionen als auch zur Überwachung der Reaktion auf die Behandlung und Bewertung von Rezidiven.
In jüngster Zeit wurde die Verwendung von Methodin effizient getestet, um das Wachstum von Sojaketten zu verbessern.
Biosynthese
Die Metionine Biosynthese wurde 1931 von British George Barger und seinem Assistenten Frederick Philip Coine beschrieben und veröffentlicht.
Bakterien und Pflanzen können Metionin und Cystein synthetisieren. Die meisten Tiere erhalten jedoch die Diät und das Cystein -Methode von einem biosynthetischen Weg, der von Metionin als anfängliches Substrat beginnt (sie erwerben auch Cystein mit den in der Ernährung konsumierten Lebensmitteln).
Biosinthetische Route
Pflanzen und Bakterien verwenden Cystein als Schwefel- und Homoserin -Quelle als Quelle für karboniertes Skelett für die Methodensynthese. Homoserina synthetisiert von Aspartat mittels drei enzymatischer Reaktionen:
(1) Das Aspartat wird durch eine Enzymaspartatkinase zu einem zu β-Asphat-Phosphat.
Der erste Schritt der Synthese von Metionin ist die Reaktion von Homoserin mit Succinyl-CoA zur Bildung von O-Succinil Homoserina. In dieser Reaktion wird Succinyl-CoA gespalten, wodurch der CoA-Teil freigegeben wird und Succinat an Homoserin bindet.
Auf dem Biosyntheseweg der regulierte oder Kontrollpass.
Der zweite Schritt der Synthes.
Die dritte Reaktion dieser Route wird durch β-Cystationin katalysiert, das das Cystatiotin bricht, so dass Schwefel mit einer Seitenkette von vier Kohlenstoffatomen verbunden ist, die aus Homoserin stammen. Das Ergebnis dieser Reaktion ist die Bildung von Homocystein und die Freisetzung von 1 Pyruvat und 1 Ion NH4+.
Es kann Ihnen dienen: Kolumbiens Flora und Fauna: Repräsentative Arten (Fotos)The last reaction is catalyzed by the Methyltransferase homocysteine, which has the substrate to homocysteine and next to the methylcobalamine coenzyme (derived from vitamin B12 (cyanocobalamine)) transfers a methyl group from 5-methyltetrahydrofolate to the sulfhydrile group of homocysteine Origin to Metionine.
In dieser Reaktion ist ein Tetrahydropholat frei.
Degradierung
Metionin, Isoleucin und Valin werden zu Succinil-CoA katabolisiert. Die drei Fünftel der Kohlenstoffe der Metionine bilden Succinyl-CoA, die Carboxilli-Kohlenstoffe bilden CO2 und die Methode des Verfahrens wird als solche beseitigt.
Der erste Schritt beim Abbau des Metionins impliziert die Kondensation des L-Methionin mit ATP durch die Adenosyltransferase L-Methionin, die zum S-Adenosyl-L-Methionin führt, das auch als "aktives Methode" bezeichnet wird.
Die S-Methylgruppe wird auf mehrere Akzeptoren übertragen, und daher wird das S-Adenosyl-L-Homocystein gebildet, der durch Hydrolyse eines Adenosins verliert und zu L-Homocystein wird. Dann verbindet sich Homocystein zum Serin, um Cystationin zu bilden. Diese Reaktion wird durch β-Sintetase Cystationin katalysiert.
Cystationin ist hydrolysiert und führt zu L-Homoserina und Cystein. So verursacht Homocystein Homoserin und Serin erzeugt Cystein.
Als Nächst. Das α-Ekthobutirat in Gegenwart von COA-SH und NAD+, Propionyl-CoA-Form, die dann zu Methylmalonil-CoA wird, und dies wird Succinil-CoA.
Auf diese Weise bildet ein Teil der karbonierten Metioninkette ein gluconeogenes Substrat, Succinyl-CoA, das dann in die Glucosesynthese integriert werden kann. Aus diesem Grund wird Methionin als glukogene Aminosäure angesehen.
Eine alternative Route für den Verschlechterung von Methoden ist die Verwendung als Energiesubstrat.
Metioninstickstoff wie alle Aminosäuren wird aus α-Transaminierungskohlenstoff entfernt, und diese α-Amino-Gruppe wird schließlich auf L-Glutamat übertragen. Aufgrund des oxidativen Herzschmerzes tritt dieser Stickstoff in den Harnstoffzyklus ein und wird durch Urin beseitigt.
Metionine Lebensmittel
Unter den metioninreichen Lebensmitteln sind:
- Das Eiweiß.
- Milchderivate wie gereiftem Käse, Frischkäse und Joghurt.
- Fisch, besonders die sogenannten blauen Fische wie Thunfisch oder Schwertfisch.
- Die Krabben, Hummer und Garnelen sind wichtige Metioninquellen.
- Schweinefleisch, Kuh und Hühnerfleisch.
- Nüsse und andere Nüsse sind reich an Metionin und repräsentieren Eiweißersatz für Vegetarier und Veganer.
- Die Sesamsamen, Kürbis und die Pistazie.
Es ist auch in weißen und schwarzen Bohnen, in Sojabohnen, in Mais und in grünem Blattgemüse wie Rübenblättern, Spinat und Mangle zu finden. Der Brokkoli, Zucchini und Kürbis sind reich an Methionin.
Vorteile Ihrer Aufnahme
Als essentielle Aminosäure ist ihre Aufnahme unverzichtbar, um alle Funktionen zu erfüllen, an denen sie teilnimmt. Durch die Förderung des Transports von Fetten für seinen Energiebrennstoff schützt das Metionin die Leber und die Arterien vor der Ansammlung von Fetten.
Seine Aufnahme ist vorteilhaft für den Schutz des Organismus vor Bedingungen wie Fettleber und Atherosklerose.
Metionin hat sich als effizient für die Behandlung einiger schwerer Fälle von Myeloneuropathien als durch Stickoxid und makrozytische Anämien induzierte Myeloneuropathien erwiesen, die nicht auf Vitamin B12 -Behandlung ansprechen.
Kann Ihnen dienen: Flora und Fauna de MorelosDie Verwendung von S-Adenosyl-L-Methionin (SAM) ist als natürliche und alternative Behandlung für Depressionen wirksam. Dies liegt daran.
Oxidativer Stress ist zumindest teilweise bei der Schädigung mehrerer Organe, einschließlich der Leber, der Nieren und des Gehirns. Die Verwendung von Antioxidantien wie Metioniner wurde postuliert, um Schäden zu verhindern und zu korrigieren, die durch oxidativen Stress verursacht werden.
Mangelerkrankungen
Es gibt einige Pathologien im Zusammenhang mit dem Metabolismus von Metionin, die mit ihrer Darmabsorption zu tun haben, was zur Akkumulation bestimmter Metaboliten oder zum offenen Defizit der Aminosäure führt.
Bei Stoffwechselstörungen von Metionin sind die so häufigsten Homocistinurien, die vom Typ I, II, III und IV von Typ I sind:
Homocystinurien vom Typ I sind auf das β-Sintetase-Cystationin-Defizit zurückzuführen und werden von klinischen Symptomen begleitet, die Thrombose, Osteoporose, Luxation der Linse und häufig mentale Verzögerung sind.
Homocystinurien vom Typ II werden durch das Defizit von N5N10-methylentetrahydropololat erzeugt. Homocystinurien vom Typ III sind auf die Abnahme der N5-Methyltetrahydropholat-Homocystein-Transmethylase durch Methylcobalamin-Synthesedefizit zurückzuführen.
Und schließlich hängen Homocystinurien vom Typ IV mit einer Verringerung der N5-Methyltetrahydropholat-Homocystein-Transmethylase aufgrund fehlerhafter Cobalaminabsorption zusammen.
Homocystinurien sind erbliche Defekte des Metabolismus von Methodin und werden in 1 zu 160 Frequenz präsentiert.000 Neugeborene. In dieser Pathologie wird täglich zusammen mit S-Adenosylmetionin täglich über 300 mg Homocistin ausgeschieden, das von einem Anstieg des Plasma-Methionins begleitet wird.
Die Verringerung der Aufnahme von Methodin und die Zunahme von Cystein in der Ernährung in frühen Lebensstadien vermeidet die durch diese Krankheiten induzierten pathologischen Veränderungen und ermöglicht eine normale Entwicklung.
Im Falle des metioninischen Malabsorptionsdefizits hängen die wichtigsten Auswirkungen auf die Myelinisierung von Nervenfasern des Zentralnervensystems (CNS) zusammen, die mit einem gewissen Grad der mentalen Verzögerung verbunden sein können.
Verweise
- Bakhoum, g. S., Badr, e. ZU. Ihnen., Sadak, m. S., Kabesh, m. ENTWEDER., & Amin, g. ZU. (2018). Verbesserung des Wachstum. Internationales Journal of Environmental Research, 13, 1-9.
- Mathews, c., Van Holde, K., & Ahern, k. (2000). Biochemie (3. Aufl.). San Francisco, Kalifornien: Pearson.
- Mischoulon, d., & Fava, m. (2002). Rolle von S-Adenosyl-L-Methionin bei der Behandlung von Depressionen: eine Überprüfung der Beweise. American Journal of Clinical Nutrition, 76(5), 1158S-1161s.
- Murray, r., Bender, d., Botham, k., Kennelly, p., Rodwell, v., & Weil, p. (2009). Harpers illustrierte Biochemie (28. ed.). McGraw-Hill Medical.
- Patra, r. C., Swarup, d., & Dwivedi, s. K. (2001). Antioxidative Wirkungen von α-Tocopherol, Ascorbinsäure und L-Methionin auf Blei induzierte oxidive Stress für Leber, Niere und Gehirn bei Ratten. Toxikologie, 162(2), 81-88.
- Rawn, j. D. (1998). Biochemie. Burlington, Massachusetts: Neil Patterson Publishers.
- Stacy, c. B., Di Rocco zu., & Gould, r. J. (1992). Methionin bei der Behandlung der Nitrou-Oxid-induzierten Neuropathie und der Myeloneuropathie. Journal of Neurology, 239(7), 401-403.
- « Die 5 Arten von Ehemannsmerkmalen und Verhaltensweisen
- Molochetymologie, Herkunft, Attribute, verschiedene Kulturen »

