Quiraralrankische Mischung, Beispiele
- 3549
- 450
- Luca Holdt
A Racmic Mix o Racmatics besteht aus zwei Enantiomeren in gleichen Teilen und ist daher optisch inaktiv. Diese optische Aktivität bezieht sich auf die Fähigkeit ihrer Lösungen, sich in einem Zeitplan oder Anti -Folie zu drehen, einen polarisierten Lichtstrahl, der sie in eine Richtung durchläuft.
Ein Enantiomer hat die Fähigkeit, das polarisierte Licht nach links zu drehen (Levógiro), sodass seine reine Lösung optisch aktiv ist. Wenn dies jedoch beginnt, das Enantiomer hinzuzufügen, das das Licht nach rechts dreht (Dextrogyry), nimmt seine optische Aktivität ab, bis es inaktiviert ist.
 Traubencluster, die eine Verwandtschaft mit Rankikmischungen jenseits der Etymologie teilen. Quelle: Pexels.
Traubencluster, die eine Verwandtschaft mit Rankikmischungen jenseits der Etymologie teilen. Quelle: Pexels. In diesem Fall wird gesagt, dass es die gleichen Mengen der Levogiro und Dextrógiro Enantiomer gibt; Wenn ein Molekül das polarisierte Licht nach links gebrochen hat, wird sein Effekt sofort aufgehoben, wenn es mit einem anderen Molekül "stolpert" wird, das es nach rechts dreht. Usw. Daher haben wir eine Rankikmischung.
Die erste Verbesserung der Sichtung des französischen Chemikers Louis Pasteur im Jahr 1848, der eine Mischung aus enantiomeren Kristallen von Tartarsäure untersuchte (zu diesem Zeitpunkt namens Ranginsäure). Wenn diese Säure aus den für die Weinproduktion verwendeten Trauben verwendet wurde, galt diese Mischung auf allgemeine Weise für alle Moleküle.
[TOC]
Schuhe und Chiralität
Erstens gibt es eine Argumentationsmischung, es muss zwei Enantiomere (gewöhnlich) sein, was impliziert, dass beide Moleküle Chirale sind und dass ihre Spiegelbilder nicht überlappbar sind. Ein Paar Schuhe zeigt dies perfekt: Egal wie sehr der linke Schuh auf der rechten Seite versucht wird, sie können niemals passen.
Kann Ihnen dienen: schwache SäureDer rechte Schuh, um zu sagen, leitet das polarisierte Licht nach links ab; während der linke Schuh es rechts macht. In einer hypothetischen Lösung, bei der Schuhe die Moleküle sind, wird dies optisch aktiv sein. Genauso wie es passieren wird, wenn nur Leftschuhe in Lösung vorhanden sind.
Wenn es jedoch tausend linke Schuhe mit tausend Rechteschuhen gemischt gibt, gibt es dann eine Rankikmischung, die ebenfalls optisch inaktiv ist, da die Abweichungen, die das Licht im Inneren leiden.
Wenn sie anstelle von Schuhen Bälle, Objekte, die aquiral sind, wäre es für sie unmöglich, Rankic -Gemische von diesen zu existieren.
Beispiele
Weinsäure
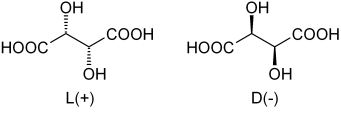 Tartarsäure Enantimere. Quelle: Dschanz [Public Domain]
Tartarsäure Enantimere. Quelle: Dschanz [Public Domain] Als er zur Tartarsäure zurückkehrte, traf sich das Rankische Misch. Im oberen Bild sind seine beiden Enantiomere dargestellt, wobei jeder Kristalle mit morphologischen Gesichtern von "links" oder "rechts" bilden kann. Pasteur gelang es, diese enantiomeren Kristalle voneinander zu trennen.
Die Kristalle der Enantiomere L (+) und D (-) zeigen die optische Aktivität getrennt, indem das polarisierte Licht nach rechts bzw. links ablenkte. Wenn beide Kristalle in denselben molaren Anteilen in Wasser auflösen, wird ein optisch inaktives Rankic -Gemisch erhalten.
Beachten Sie, dass beide Enantiomere zwei chirale Kohlenstoffe haben (mit vier verschiedenen Substituenten). Im L (+) befinden sich die OH hinter der Ebene, die vom Kohlenstoffskelett und den Cooh -Gruppen gebildet wird; Während in D (-) sind diese OH über das Flugzeug über das Flugzeug.
Diejenigen, die Tartarsäure synthetisieren. Um das Enantiomer L (+) von D (-) zu trennen.
Kann Ihnen dienen: Kupfersulfid: Struktur, Eigenschaften, verwendetChinin
 Strukturskelett des Chininmoleküls. Quelle: Benjah-BMM27.
Strukturskelett des Chininmoleküls. Quelle: Benjah-BMM27. Um sich im vorherigen Beispiel auf eine rankische Mischung aus Tartarsäure zu beziehen, wird es normalerweise als Säure (±) -Tartarisch geschrieben. Somit ist es im Fall von Chinin (überlegenes Bild) (±) -quinina.
Die Isomerie des Chinin ist komplex: Es hat vier chirale Kohlenstoffe, was zu sechzehn Diasternoisomeren führt. Interessanterweise sind zwei seiner Enantiomere (einer mit der OH über der Ebene und der andere darunter) tatsächlich Diasthelisomere, da sie sich in den Konfigurationen ihrer anderen chiralen Kohlenstoffe unterscheiden (die des Fahrrads mit dem N -Atom von N).
Jetzt ist es schwierig zu spezifizieren, welcher der Stereoisomere des Chinin das polarisierte Licht nach rechts oder nach links leitet.
Talidomid
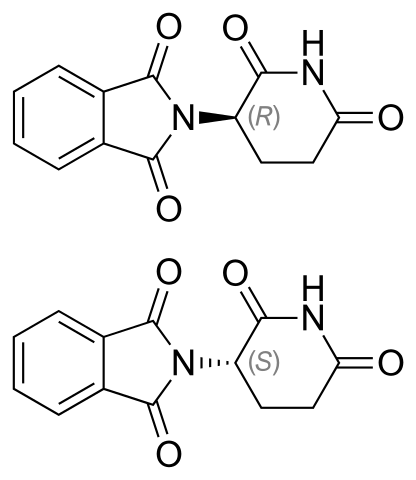 Talaidomid Enantimers. Quelle: Impfstoff [Public Domain]
Talaidomid Enantimers. Quelle: Impfstoff [Public Domain] Talidomid Enantiomere sind oben gezeigt. Es hat nur einen quiralen Kohlenstoff: Derjenige, der mit Stickstoff verbunden ist, das sich beide Ringe verbindet (einer von Phthalimida und der anderen von Gluteramid).
Im Enantiomer R (mit Beruhigungsmittel) ist der Phthalimida -Ring (der links) über der Ebene ausgerichtet; während in Enantiomer (mit mutagenen Eigenschaften) unten, unten.
Der Prozentsatz der beiden ist nicht bekannt, welches der beiden das Licht nach links oder rechts leitet. Was bekannt ist, ist, dass eine Mischung 1: 1 oder 50% beider Enantiomere das Rankic -Gemisch (±) -Talidomid bildet.
Wenn Sie das Talidomid nur als hypnotisches Beruhigungsmittel vermarkten möchten, ist es obligatorisch, seine rankische Mischung an die bereits genannte chirale Auflösung einzureichen, damit das reine Enantiomer erhalten wird.
Kann Ihnen dienen: quaternäre Verbindungen: Merkmale, Schulungen, Beispiele1,2-Epoxipropan
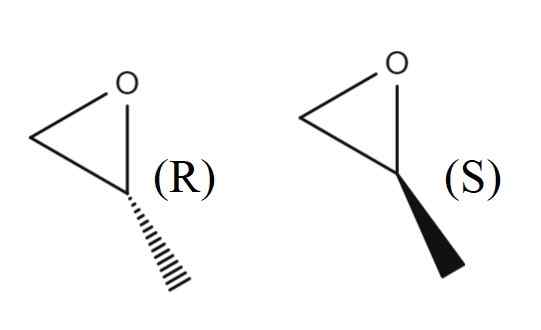 1,2-Epoxipropan-Enantiomere. Quelle: Gabriel Bolívar.
1,2-Epoxipropan-Enantiomere. Quelle: Gabriel Bolívar. Im oberen Bild haben Sie ein Paar von Enantiomeren von 1,2-Epoxipropano. Das Enantiomer renkt das polarisierte Licht nach rechts, während die S es nach links leitet; Das heißt, das erste ist das (r)-(+)-1,2-epoxipropano und die zweiten (s)-(-)-1,2-epoxipropano.
Das Rankic -Gemisch von ihnen zwei in einem Verhältnis von 1: 1 oder 50%wird (±) -1,2 -Epoxipropan (±) -1,2 -Epoxipropan.
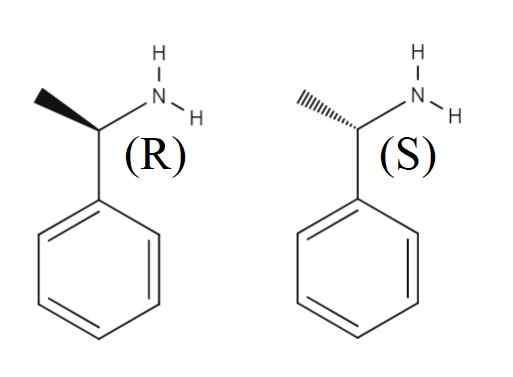
1-Phenylethylamin
 Enantiomere von 1-Penylethylamin. Quelle: Gabriel Bolívar.
Enantiomere von 1-Penylethylamin. Quelle: Gabriel Bolívar. Oben ein weiteres Rankischmisch. Das Enantiomer r ist (r)-(+)-1-phenylethylamin und enantiomer s (s)-(-)-1 feniletilamin; Man hat die Methylgruppe, Cho3, Außerdem außerhalb der aromatischen Ringebene und der anderen darunter zeigen.
Beachten Sie, dass wenn die Konfiguration R ist, sie manchmal mit der Tatsache zusammenfällt, dass der Enantiómero das polarisierte Licht nach rechts dreht. Es gilt jedoch nicht immer und kann nicht als allgemeine Regel angenommen werden.
Abschließender Kommentar
Wichtiger als die Existenz oder nicht der Rankikmischungen ist die chirale Auflösung derselben. Dies gilt insbesondere für Verbindungen mit pharmakologischen Effekten, die von solchen Stereoisom abhängen. Das heißt, ein Enantiomer kann für den Patienten von Vorteil sein, während das andere es beeinflussen kann.
Aus diesem Grund werden diese chiralen Auflösungen auf getrennte Rankikmischungen in ihren Komponenten zurückgegriffen und sie somit als reine Drogen, die frei von schädlichen Verunreinigungen sind, vermarkten.
Verweise
- Morrison, r. T. und Boyd, r, n. (1987). Organische Chemie. 5. Ausgabe. Editorial Addison-Wesley Interamerikaner.
- Carey f. (2008). Organische Chemie. (Sechste Ausgabe). Mc Graw Hill.
- Graham Solomons t.W., Craig b. Braten. (2011). Organische Chemie. Amine. (10. Ausgabe.). Wiley Plus.
- Steven a. Hardinger. (2017). Illustriertes Glossar der organischen Chemie: Racemic -Mischung. Abteilung für Chemie & Biochemie, UCLA. Erholt von: Chem.UCLA.Edu
- Nancy Devino. (2019). Racemic -Mischung: Definition & Beispiel. Lernen. Erholt von: Studium.com
- James Ashenhurst. (2019). Stereochemie und Chiralität: Was ist eine racemische Mischung? Erholt von: Masterorganicchemistry.com
- John c. Leffingwell. (2003). Chiralität & Bioaktivität i.: Pharmakologie. [PDF]. Erholt von: Leffingwell.com

