Mikrofilamente Eigenschaften, Struktur, Funktionen, Pathologie
- 3473
- 705
- Ivan Pressler
Der Mikrofilamente o Aktinfilamente sind eine der drei grundlegenden Komponenten des eukaryotischen Zellzytoskeletts.
In Eukaryoten sind die Gene, die für Aktin -Mikrofilamente kodieren.
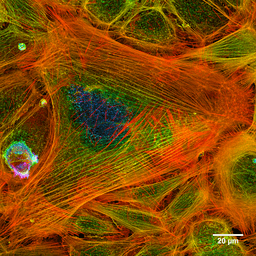
 Foto der Aktinfilamente einer gefärbten Zelle (Quelle: Howard Vindin [CC BY-SA 4.0 (https: // creativecommons.Org/lizenzen/by-sa/4.0)] über Wikimedia Commons)
Foto der Aktinfilamente einer gefärbten Zelle (Quelle: Howard Vindin [CC BY-SA 4.0 (https: // creativecommons.Org/lizenzen/by-sa/4.0)] über Wikimedia Commons) Mikrofilamente sind im gesamten Cytosol verteilt, sind jedoch in der darunter liegenden Region der Plasmamembran besonders häufig.
Mikrofilamentnetzwerke im Zytoplasma von Säugetierzellen werden von zwei der sechs für Actin beschriebenen Gene kodiert, die an der Dynamik von Mikrofilamenten beteiligt sind und die während der Differenzierung der Stammzellen sogar sehr wichtig sind.
Viele Autoren sind sich einig, dass Mikrofilamente die vielfältigsten, vielseitigsten und wichtigsten Proteine des Zytoskeletts der meisten eukaryotischen Zellen sind, und es ist wichtig, sich daran zu erinnern, dass diese bei prokaryotischen Mikroorganismen nicht gefunden werden.
In dieser Art von Zellen gibt es jedoch homologe Filamente für Mikrofilamente, die jedoch durch ein anderes Protein: MREB -Protein gebildet werden.
Gegenwärtig wird angenommen, dass das Gen, das für dieses Protein kodiert. Die Aminosäuresequenz -Homologie, die MREB -Protein bildet.
Wie ein grundlegender Bestandteil des Zytoskeletts, können jeder phänotypische Defekt sowohl in Mikrotubuli als auch in Zwischenfilamenten und Actin -Mikrofilamenten (Zytoskelett) unterschiedliche Zell- und systemische Pathologien verursachen.
[TOC]
Eigenschaften und Struktur
Mikrofilamente bestehen aus Proteinmonomeren der Actin -Familie, die in eukaryotischen Zellen äußerst reichlich vorhanden sind, da sie auch an der Muskelkontraktion beteiligt sind.
Diese Filamente haben einen Durchmesser zwischen 5 und 7 nm, daher sind sie auch als dünne Filamente bekannt und bestehen aus zwei Formen von Aktin: der kugelförmigen Form (Aktin G) und der filamentösen Form (Actin F).
Proteine, die am Zytoskelett beteiligt sind.
Kann Ihnen dienen: Zytoplasma: Funktionen, Teile und EigenschaftenDer Anteil des kugelförmigen Actin und des filamentösen Actin im Cytosol hängt von den zellulären Bedürfnissen ab, da Mikrofilamente sehr variable und vielseitige Strukturen sind, die aufgrund von Polymerisation und Depolymeterisierung ständig Wachstum und Verkürzung sind.
Actin G ist ein kleines kugelförmiges Protein, das aus fast 400 Aminosäuren und etwa 43 kDa -Molekulargewicht besteht.
Wirkungsmonomere, aus denen die Mikrofilamente ausmachen.
Aktin G ist mit einem Ca2+ -Molekül und einem anderen ATP verbunden, das seine kugelförmige Form stabilisiert; Während Actin F nach der Hydrolyse des terminalen Phosphat des ATP -Moleküls in Aktin G erhalten wird, was zur Polymerisation beiträgt.
Organisation
Aktinfilamente können in Form von "Strahlen" oder "Netzwerken" organisiert werden, die unterschiedliche Funktionen in den Zellen haben. Die Strahlen bilden parallele Strukturen, die durch ziemlich starre Kreuzbrücken verbunden sind.
Netzwerke hingegen sind komfortablere Strukturen wie dreidimensionale Maschen mit den Eigenschaften von halbsoliden Gelen.
Es gibt viele Proteine, die mit Aktin- oder Mikrofilamentfilamenten assoziiert sind und als ABP bezeichnet werden (aus Englisch Aktinbindende Proteine), die dafür bestimmte Websites haben.
Viele dieser Proteine ermöglichen es Mikrofilamenten.
Unter anderen Proteinen, die mit Mikrofilamenten interagieren, sind Kernblätter und Spektrin (in roten Blutkörperchen).
Wie werden Aktinfilamente gebildet??
Da sich globuläre Aktinmonomere immer in die gleiche Weise in die gleiche Richtung orientieren, haben Mikrofilamente eine definierte Polarität mit zwei Extremen: eins "mehr" und eine "weniger".
Die Polarität dieser Filamente ist sehr wichtig, da sie aufgrund ihres positiven Endes erheblich schneller werden, wenn die neuen Aktin -Monomere hinzugefügt werden.
 Grafische Darstellung von Actin -Mikrofilamenten (Quelle: Derivatarbeit: Retama (Diskussion) dünne_Filament_formation.SVG: Mikael Häggström [Public Domain] über Wikimedia Commons)
Grafische Darstellung von Actin -Mikrofilamenten (Quelle: Derivatarbeit: Retama (Diskussion) dünne_Filament_formation.SVG: Mikael Häggström [Public Domain] über Wikimedia Commons) Das erste, was während der Polymerisation von Aktinfilamenten stattfindet.
Kann Ihnen dienen: PlasomolyseZu diesem Trimmer werden neue Monomere von beiden Enden hinzugefügt, damit das Filament wächst. Aktin-Monomere können mit jeder Vereinigung ATP hydrolysieren, was Auswirkungen auf die Polymerisation hat, da Aktin-ATP-Teile mehr Schwierigkeiten als Actin-ADP dissoziieren.
Die ATP ist für die Polymerisation nicht erforderlich, und die Betonfunktion seiner Hydrolyse wurde noch nicht geklärt.
Einige Autoren sind der Ansicht, dass Actin -Polymerisationsereignisse schnell sind.
Verordnung
Sowohl die Polymerisation von Aktinfilamenten als auch ihre Depolimerisierung sind Prozesse, die durch eine Reihe spezifischer Proteine stark reguliert werden, die für den Umbau der Filamente verantwortlich sind.
Beispiel für die Proteine, die Depolymere regulieren. Ein anderes Protein, Prophylaine, hat eine entgegengesetzte Funktion, da es die Assoziation von Monomeren stimuliert (indem ADPs Austausch gegen ATP stimuliert).
Funktionen
Mikrofilamente interagieren mit Myosinfilamenten, die mit Transmembranproteinen verbunden sind, die eine Domäne in Cytosol und eine andere Auslandszelle haben, sodass sie an Zellmobilitätsprozessen teilnehmen.
Diese mit der Plasmamembran verbundenen Mikrofilamente vermitteln unterschiedliche zelluläre Reaktionen auf verschiedene Arten von Stimuli. Beispielsweise wird die Zelladhäsion von Epithelgeweben durch Transmembranproteine geleitet, die als Cadherinas bekannt sind, die mit Mikrofilamenten interagieren, um Reaktionsfaktoren zu rekrutieren.
Aktinfilamente interagieren mit Zwischenfilamenten, um extrazelluläre Stimuli an Schlüsselstellen wie Ribosomen und Chromosomen im Kern zu übertragen.
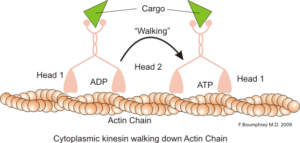 Darstellung der intrazellulären motorischen Funktion von Actin-Mikrofilamenten (Quelle: Boumphreyfr [CC BY-SA 3.0 (https: // creativecommons.Org/lizenzen/by-sa/3.0)] über Wikimedia Commons)
Darstellung der intrazellulären motorischen Funktion von Actin-Mikrofilamenten (Quelle: Boumphreyfr [CC BY-SA 3.0 (https: // creativecommons.Org/lizenzen/by-sa/3.0)] über Wikimedia Commons) Eine klassische und sehr untersuchte Funktion von Mikrofilamenten ist seine Fähigkeit, „Brücken“, „Schienen“ oder „Autobahnen“ für die Bewegung des Myosin -Motorproteins I zu bilden, das Transportbläschen von den Organellen zum Membranplasma auf dem Sekretion laden kann Wege.
Mikrofilamente interagieren auch mit Myosin II, um den kontraktilen Ring zu etablieren, der während der Zytokinese gebildet wird, genau während der letzten Stufe der Zellteilung, in der das Cytosol vom Stamm- und Tochterzellen getrennt ist.
Kann Ihnen dienen: Polymorphonukleäre LeukozytenIm Allgemeinen modulieren von ACTIN -veränderte Mikrofilamente die Verteilung einiger Organellen wie dem Golgi -Komplex, des endoplasmatischen Retikulums und der Mitochondrien. Darüber hinaus nehmen sie auch an der räumlichen Positionierung der RNMs teil, damit sie von den Ribosomen gelesen werden.
Das gesamte Mobiltelefonsatz von Mikrofilamenten, insbesondere solchen, die eng mit der Plasmamembran verwandt sind.
Sie beteiligen sich auch an der Bildung von Mikrovings und anderen häufigen Protuberanzen auf der Oberfläche vieler Zellen.
Beispiel für Funktionen in der Leber
Mikrofilamente beteiligen sich am Gallensekretionsprozess in Hepatozyten (Leberzellen) und auch in peristaltischen Bewegungen (koordinierte Kontraktion) von Leberkanaliculi.
Sie tragen zur Differenzierung von Plasmamembrandomänen bei ihrer Assoziation mit verschiedenen zytosolischen Elementen und der Kontrolle, die sie auf die Topographie dieser intrazellulären Elemente ausüben.
Verwandte Pathologien
Es gibt nur wenige Krankheiten, die mit primären Defekten in der Struktur oder mit Proteinen und regulatorischen Enzymen in der Synthese von Mikrofilamenten assoziiert sind, obwohl diese direkt an einer großen Anzahl von Funktionen beteiligt sind.
Der niedrige Index von Krankheiten und Missbildungen in der Primärstruktur von Mikrofilamenten beruht auf der Tatsache, dass es im Allgemeinen mehrere kodierende Gene von Actin und seine regulatorischen Proteine gibt, ein Phänomen, das als "genetische Redundanz" bekannt ist.
Eine der am häufigsten untersuchten Pathologien ist die Vitrifizierung von Oozyten auf ihrem Zytoskelett, bei dem im kortikalen Mikrofilament -Netzwerk eine Unterbrechung sowie eine Depolimerisierung und eine Desorganisation der Mikrotubuli der mitotischen Spindel beobachtet wird.
Im Allgemeinen verursacht diese Verglasung eine chromosomale Dispersion, da sie zu einer Meinungsverschiedenheit bei der Verdichtung des gesamten Chromatins führt.
Die Zellen, die eine größere Organisation und ein größerer Anteil von Mikrofilamenten in ihrem Zytoskelett haben.
Defekte oder atypische Mikrofilamente wurden auch mit Knochenerkrankungen in Verbindung gebracht, die als Paget -Erkrankung bekannt sind.
Verweise
- Aguilar-Cuenca, R., Llorente-González, c., Vicente, c., & Vicente-manzanares, m. (2017). Mikrofilament-koordinierte Adhäsionsdynamik treibt einzelne Zellmigration und Formen an, an denen Gewebe. F1000Resarch, 6.
- Zwei Mittel, c. G., Chhabra, d., Kekic, m., Finger, ich. V., Tsubakihara, m., Berry, d. ZU., & Nosworthy, n. J. (2003). Bindungsproteine Actin: Regulation von Zytoskelett -Mikrofilamenten. Physiologische Bewertungen, 83(2), 433-473.
- Guo, h., Fauci, l., Shelley, m., & Kanso und. (2018). Bistabilität bei der Synchronisation von betätigten Mikrofilamenten. Journal of Fluid Mechanics, 836, 304-323.
- Start., Langer, r., & Vacanti, j. P. (Hrsg.). (2011). Prinzipien des Tissue Engineering. Akademische Presse.
- Robbins, j. (2017). Krankheiten des Zytoskeletts: Die Deminopathien. In kardioskaretaler Myopathien bei Kindern und Youun -Erwachsenen (PP. 173-192). Akademische Presse.
- « Merkmale von Grizzlybären, Lebensraum, Nahrung, Verhalten
- Cistus clusii Merkmale, Taxonomie, Lebensraum, Verteilung, verwendet »

