Myeloperoxidase -Eigenschaften, Struktur, Funktionen
- 4806
- 812
- Tizian Liebich
Der Myeloperoxidase Es handelt.
Diese lysosomale Peroxidase findet sich in den Granulozyten und Monozyten von Säugetieren und Übungen Funktionen im Mikrobikid -System, das vom Wasserstoffperoxid von Neutrophilen abhängt und Teil der Komponenten der angeborenen Immunantwort ist.
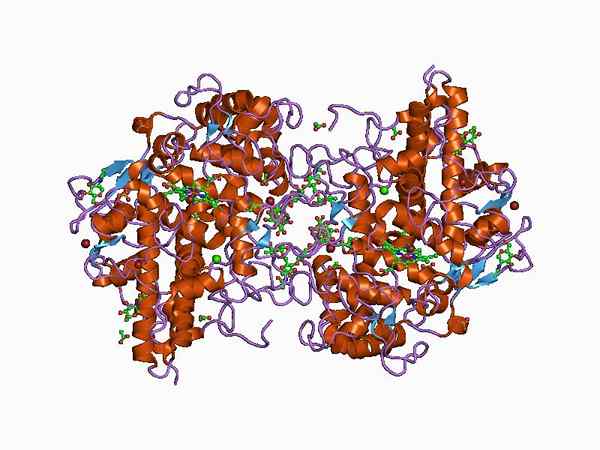
 Darstellung der Struktur des Myeloperoxidase -Enzyms (Quelle: Jawahar Swaminathan und MSD -Mitarbeiter des Europäischen Bioinformatikinstituts [Public Domain] über Wikimedia Commons)
Darstellung der Struktur des Myeloperoxidase -Enzyms (Quelle: Jawahar Swaminathan und MSD -Mitarbeiter des Europäischen Bioinformatikinstituts [Public Domain] über Wikimedia Commons) Es wurde erstmals von Agner beschrieben, der den ersten Begriff von "Verdoperoxidase" geprägt hat, da es sich um ein Enzym mit einer charakteristischen grünen Farbe handelt.
Einige Zeit später wurde sein Name in Myeloperoxidase geändert, da es sich um ein charakteristisches Enzym der Zellen der myeloischen Linien aus dem Knochenmark handelt und in verschiedenen Bindegeweben des Körpers einiger Tiere vorhanden ist.
Zusätzlich zu seinen Funktionen im Immunsystem für den Kampf der eindringenden Mikroorganismen verursachen die Produkte der durch Myeloperoxidase katalysierten Reaktionen bei verschiedenen entzündlichen Reaktionen Gewebeschäden.
Seine Aktivität stand auch mit der Entwicklung einiger kardiovaskulärer Erkrankungen und in den Phasen der Initiierung, Ausbreitung und Komplikation von atherosklerotischen Prozessen, die für die Diagnose und therapeutische Intervention dieser Pathologien genutzt werden.
[TOC]
Eigenschaften
Die katalytische Funktion der Myeloperoxidase basiert auf der Oxidation von zwei Elektronen des Klassen.
Dieses Enzym ist besonders in primären azurophilen Granulaten im Zytoplasma von polymorphonukleären Leukozyten vorhanden, wo es mehr als 3% des Gewichts dieser Zellen repräsentiert. Es kommt auch in menschlichen Monozyten vor, jedoch nicht in Gewebe -Makrophagen.
Es kann Ihnen dienen: Woese -Klassifizierung (3 Domänensystem)Myeloperoxidase wird von einem 2 -Gen kodiert.200 Basispaare (2).2 kb), der für die Synthese eines Vorläuferpeptids von 745 Aminoaceous -Abfällen verantwortlich ist.
Beim Menschen befindet sich dieses Gen auf Chromosom 17 in der 12-23-Region des langen Arms und enthält 12 Exons und 11 Introns.
Die Synthese dieses Proteins tritt im promielozytischen Stadium der Differenzierung myeloischer Linienzellen auf, und ihre posttranslationale Verarbeitung tritt zwischen dem endoplasmatischen Retikulum, dem Golgi-Komplex und der Plasmamembran auf.
Der Einbau der Hämoprothesegruppe erfolgt unabhängig von der posttranslationalen Verarbeitung des inaktiven Vorläuferproteins.
Struktur
Myeloperoxidase wird als glykosyliertes Vorläuferprotein (mit Kohlenhydratabschnitten) von etwa 90 kDa synthetisiert. Dies wird anschließend in zwei Ketten aufgeteilt: einen schweren (55-60 kDa) und ein Licht (10-15 kDa).
Das reife Protein besteht aus zwei schweren und zwei leichten Ketten, die einen 120 bis 160 kDa -Tetler bilden, wobei zwei identische Prothesengruppen in jedem TETROUS.
Die schwere Kette hat 467 Aminosäuren und befindet sich am C-terminalen Ende des Proteins, während die leichte Kette aus 108 Abfällen besteht.
In polymorphonukleären Leukozyten wurden mindestens drei Isoformen dieses Enzyms beschrieben, bekannt als I, II und III und in HL-60-Tumorpromielozytischen Zellen (Vorläuferzellen) Vier wurden vier beschrieben, namens AI, IB, II und III.
Myeloperoxidasen Typ I, II und III von Polymorphonuklear haben Molekulargewichte von 120, 115 bzw. 110 kDa, und ihre Aminosäurezusammensetzung variiert nicht erheblich. Sie haben einen hohen Anteil an Aspartat-, Glutamat-, Leucin- und Prolinabfällen sowie Aminoazúcar N-Acetylglucosamin im Sacararida-Teil.
Kann Ihnen dienen: Beta -Oxidation von Fettsäuren: Schritte, Reaktionen, Produkte, RegulationDie prothetische Gruppe dieser Enzyme enthält Eisenatome, und der Gehalt dieses Metalls variiert je nach den untersuchten Tierarten. Es wird angenommen, dass diese Gruppe kovalent mit den schweren Untereinheiten der Struktur verbunden ist, was für die enzymatische Aktivität wichtig ist.
Funktionen
Myeloperoxidase ist Teil des "Myeloperoxidase -Systems" bekannt und wirkt während der Phagozytose von eindringenden Mikroorganismen, die von verschiedenen oxidativen Reaktionen begleitet sind und Teil der phagozytischen Vakuolen sind.
Dieses Myeloperoxidase -System ist an der Eliminierung von Bakterien, Viren, Parasiten und Pilzen beteiligt.
Die Systemkomponenten sind Myeloperoxidase -Enzym, Wasserstoffperoxid und ein oxidierbarer Faktor wie ein Haluro. Wasserstoffperoxid wird während des Atmens durch Intermediary Superxides Anionen erzeugt.
Dieses Peroxid kann mit Myeloperoxidase reagieren, um das zu bilden, was als Verbindung I genannt wird, was verschiedene Haluros "angreifen" kann. Wenn die Verbindung I mit anderen Elektronendonormolekülen reagiert, wird sie Verbindung II, aber dies ist nicht in der Lage, mit Haluros zu reagieren.
Die Haluros, die ich verwende, kann Chloride, Bromide, Iodide und die Pseudo Haluro Tiocianato sein; Die häufigsten für diese Enzyme, gemäß den Experimenten In vivo, Sie sind die Chloride, die nach Myeloperoxidase nach Hypochlorsäure und anderen Derivaten verwandelt werden, die starke "Keimmoleküle" sind.
Andere Reaktionen, die durch das gleiche Enzym katalysiert wurden.
Es kann Ihnen dienen: Lia Agar (Eisenlysin): Was ist, Fundament, Vorbereitung, verwendetIn der Krankheitsentwicklung
Das Myeloperoxidase -Enzym ist an der Förderung und Ausbreitung von Atherosklerose beteiligt, da es das oxidative Potential von Wasserstoffperoxid durch die Herstellung von starken Oxidationsmitteln, die verschiedene Phenolverbindungen beeinflussen können, verstärkt.
Diese reaktiven Arten sind am Auftreten von Gewebeläsionen beteiligt, die während einer Vielzahl von entzündlichen Erkrankungen auftreten.
Der Anstieg der systemischen Spiegel dieses Enzyms wird als diagnostischer Marker für die Existenz von koronaren Herzerkrankungen und anderen wichtigen Herzerkrankungen verwendet.
Zusätzlich zu ihrer Beziehung zu einigen Herzerkrankungen führen Defekte in Myeloperoxidase auch zu immunen pathologischen Erkrankungen, da Defekte in ihrer bakteriziden Aktivität zu gefährlichen und akuten systemischen Infektionen führen können.
Verweise
- Kimura, s., & Ikeda-saito, m. (1988). Humane Myeloperoxidae und Schilddrüsenperoxidase, zwei Enzyme mit getrennten und unterschiedlichen physiologischen Funktionen, sind evolutionäre Mitglieder derselben Gen -Genfamilie. Proteine: Struktur, Funktion und Bioinformatik, 3, 113-120.
- Klebanoff, s. J. (1999). Myeloperoxidae. Phagozyten antimikrobielle Systeme, 111(5), 383-389.
- Klebanoff, s. J. (2005). Myeloperoxidae: Freund und Feind. Journal of Leukozytenbiologie, 77, 598-625.
- Koeffler, p., Ranyard, J., & Pertcheck, m. (1985). Myeloperoxidae: seine Struktur und Expression während der Myeloiddifferenzierung. Blut, 65(2), 484-491.
- Nicholls, s. J., Hazen, s. L., Nicholls, s. J., & Hazen, s. L. (2005). Myeloperoxidae und Herz -Kreislauf -Erkrankungen. Arteriosklerose, Thrombose und Gefäßbiologie, 25, 1102-1111.
- Tobler, a., & Koefter, h. P. (1991). Myeloperoxidae: Lokalisierung, Struktur und Funktion. In Blutzellenbiochemie (pp. 255-288). New York: Plenum Press.

