Myofibrilleneigenschaften, Struktur, Zusammensetzung, Funktionen
- 2026
- 22
- Timo Rabenstein
Der Myofibrillen Sie sind die strukturellen Einheiten von Muskelzellen, auch als Muskelfasern bekannt. Sie sind sehr reichlich vorhanden, sie sind parallel fixiert und durch das Cytosol dieser Zellen eingebettet.
Schicht Muskelfaserzellen oder Fasern sind sehr lange Zellen, die bis zu 15 cm lang und von 10 bis 100 μm Durchmesser messen können. Seine Plasmamembran ist als Sarcolema und sein Cytosol als Sarkoplasma bekannt.
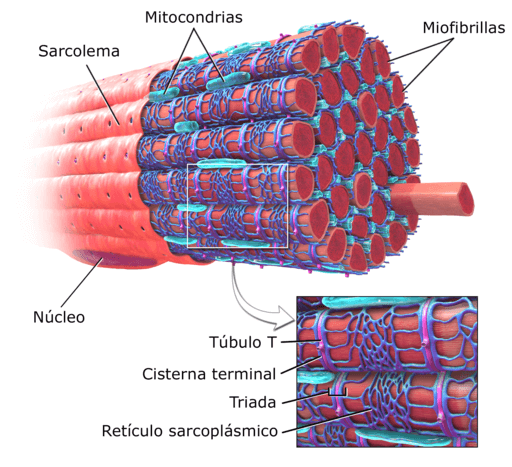
 Diagramm der Muskelstruktur eines menschlichen Wesens (Quelle: DEGLR6328 ~ Commonswiki, über Wikimedia Commons)
Diagramm der Muskelstruktur eines menschlichen Wesens (Quelle: DEGLR6328 ~ Commonswiki, über Wikimedia Commons) Innerhalb dieser Zellen befinden sich zusätzlich zu Myofibrillen mehrere Kerne und Mitochondrien, die als Sarkosomen bekannt sind, sowie ein herausragendes endoplasmatisches Retikulum, das als sarcoplasmatisches Retikulum bekannt ist.
Myofibrillen werden als "kontraktile Elemente" der Muskeln bei Wirbeltieren anerkannt. Sie bestehen aus verschiedenen Arten von Proteinen, die ihnen die elastischen und einziehbaren Eigenschaften geben. Außerdem besetzen sie einen wichtigen Teil des Sarkoplasma von Muskelfasern.
[TOC]
Unterschiede zwischen Muskelfasern
Es gibt zwei Arten von Muskelfasern: gestreifte und glatte Fasern mit jeweils eine anatomische Verteilung und eine bestimmte Funktion. Myofibrillen sind besonders wichtig und deutlich in gestreiften Muskelfasern, die den Skelettmuskel ausmachen.
Die gestreiften Fasern haben ein sich wiederholendes Muster von Querbändern, wenn sie in einem Mikroskop beobachtet werden und mit Skelettmuskeln und einem Teil der Herzmuskulatur assoziiert sind.
Im Gegenteil die glatten Fasern präsentieren nicht dasselbe Muster unter dem Mikroskop und befinden sich in den charakteristischen Muskeln des Gefäßsystems und des Verdauungssystems (und alle Eingeweide).
Allgemeine Charakteristiken
Myofibrillen bestehen aus zwei Arten von kontraktilen Filamenten (auch als Myofilamente bezeichnet), die wiederum aus Myosin- und Aktinfilamentproteinen bestehen, die später beschrieben werden.
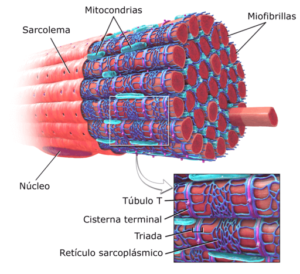 Grafische Darstellung von Myofibrillen im Skelettmuskel (Quelle: modifiziert Brublaus [CC BY-SA 3.0 (https: // creativecommons.Org/lizenzen/by-sa/3.0)] über Wikimedia Commons)
Grafische Darstellung von Myofibrillen im Skelettmuskel (Quelle: modifiziert Brublaus [CC BY-SA 3.0 (https: // creativecommons.Org/lizenzen/by-sa/3.0)] über Wikimedia Commons) Verschiedene Forscher haben festgestellt, dass die durchschnittliche Lebensdauer der kontraktilen Proteine von Myofibrillen von 5 Tagen bis 2 Wochen dauert, so.
Die funktionelle Einheit jeder Myofibrilla in Muskelzellen oder Fasern wird als Sarkomrover bezeichnet und wird durch eine Region, die als „Band oder Linie Z“ bekannt ist.
Da Myofibrillen einen wesentlichen Teil des Sarkoplasma einnehmen, beschränken diese faserigen Strukturen die Lage der Zentren der Zellen, zu.
Es kann Ihnen dienen: menschliche Zelle: Eigenschaften, Funktionen, Teile (Organellen)Einige menschliche Pathologien hängen mit der Verschiebung der Kerne in myofibrilläre Balken zusammen, und diese sind als zentral-nukleare Myopathien bekannt.
Bildung von Myofibrillen oder "Myofibrillogenese"
Die ersten Myofile werden während der Entwicklung des embryonalen Skelettmuskels zusammengesetzt.
Die Proteine, aus denen die Sarkomer (die funktionellen Einheiten von Myofibrillen) ausmachen.
In den Muskelfasern, die sie exprimieren, exprimieren sie in unterschiedlichen Proportionen die codierenden Gene für die Herz- und Skelettisoformen des α-Actin. Zuerst ist die Menge an kardialen Isoform, die exprimiert wird, größer und dann ändert sich dies am Skelett.
Nach der Bildung des Preis.
Zu diesem Zeitpunkt sind Myosinfilamente mit anderen spezifischen Proteinen der Myosin -Union ausgerichtet und komplex, was auch bei Aktinfilamenten auftritt.
Struktur und Zusammensetzung
Wie vor einem Moment erwähnt, bestehen Myofibrillen aus kontraktilen Protein -Myofilamenten: Actin und Myosin, die auch als dünne bzw. dicke Myofilamente bekannt sind. Diese sind für optisches Mikroskop sichtbar.
- Dünne Myofilamente
Die dünnen Filamente von Myofibrillen bestehen aus Aktinprotein in seiner filamentösen Form (Actin F), ein Polymer in der kugelförmigen Form (Actin G), das eine kleinere Größe hat.
Die filamentösen Stränge von Aktin (Aktin f) bilden einen Doppelstrang, der in Propellerform eingewickelt ist. Jedes Monomer von diesen wiegt mehr oder weniger 40 kDa und kann an bestimmten Stellen Myosin beitreten.
Diese Filamente haben einen Durchmesser von etwa 7 nm und erstrecken sich zwischen zwei als Band I und Band A bekannt. In der A -Band befinden sich diese Filamente um die dicken Filamente, die eine sekundäre hexagonale Anordnung bilden.
Insbesondere ist jedes dünne Filament symmetrisch von drei dicken Filamenten getrennt, und jedes dicke Filament ist von sechs dünnen Filamenten umgeben.
Dünne und dicke Filamente interagieren miteinander durch „Kreuzbrücken“, die sich von den dicken Filamenten abheben und die in regelmäßigen Abständen in der Struktur der Myofibrilla auftreten.
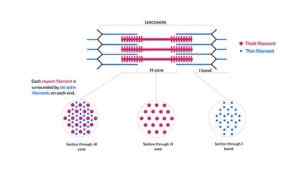 Schematische Darstellung von Myofilamenten, die Myofibrillen und ihre Kreuzschnitte ausmachen (Quelle: Kamran Maqsood 93 [CC BY-SA 4.0 (https: // creativecommons.Org/lizenzen/by-sa/4.0)] über Wikimedia Commons)
Schematische Darstellung von Myofilamenten, die Myofibrillen und ihre Kreuzschnitte ausmachen (Quelle: Kamran Maqsood 93 [CC BY-SA 4.0 (https: // creativecommons.Org/lizenzen/by-sa/4.0)] über Wikimedia Commons) Aktinfilamente und andere damit verbundene Proteine erstrecken sich aus den "Kanten" von Z -Zeilen und überlappen sich mit Myosinfilamenten in Richtung der Mitte jedes Sarkomeros.
Es kann Ihnen dienen: Zelluläre Ernährung: Prozess und Nährstoffe- Dicke Myofilamente
Dicke Filamente sind Polymere des Myosin -II -Proteins (jeweils 510 kDa) und werden durch die als "Bands A" bekannten Regionen abgrenzt.
Myofilamente von Myosin sind ungefähr 16 nm lang und sind in hexagonalen Anordnungen verteilt (wenn ein Querschnitt einer Myofibrilla beobachtet wird).
Jedes Myosin -II -Filamente besteht aus vielen verpackten Myosinmolekülen, von denen jedes aus zwei Polypeptidketten besteht, die eine Region oder einen „Kopf“ in Form eines Maza haben und die in „Trauben“ zur Bildung der Filamente bilden.
Beide Bündel werden durch ihre Enden in der Mitte jedes Sarkomers aufrechterhalten, so dass die "Köpfe" jedes Myosins in Richtung der Z -Linie gerichtet sind, wo die dünnen Filamente festgelegt sind.
Myosinköpfe erfüllen sehr wichtige Funktionen, da sie Gewerkschaftsstellen für ATP -Moleküle haben und außerdem während der Muskelkontraktion die Kreuzbrücken bilden können, um mit den dünnen Filamenten von Actin zu interagieren.
- Assoziierte Proteine
Aktinfilamente sind dank ihrer Wechselwirkung mit einem anderen Protein, der als Dystrophin bekannt ist.
Darüber hinaus gibt es zwei wichtige Aktin -Union -Proteine, die als Troponin und Tropomiosin bekannt sind, die zusammen mit Aktinfilamenten einen Proteinkomplex bilden. Beide Proteine sind für die Regulierung von Wechselwirkungen zwischen dünnen und dicken Filamenten wesentlich.
Tropomiosin ist ebenfalls ein zwei -zerstörtes filamentares Molekül. Troponin ist ein dreigliedriger globulärer Proteinkomplex, der in Abständen über Aktinfilamente erhältlich ist.
Dieser letzte Komplex wirkt als calciumabhängiger "Switch", der die Kontraktion der Muskelfasern reguliert. Daher ist er von größter Bedeutung.
Im gestreiften Muskel von Wirbeltieren gibt es außerdem zwei weitere Proteine, die mit den dicken und dünnen Filamenten interagieren, die als Titina bzw. Nebulina bekannt sind.
Das Nebulin hat wichtige Funktionen bei der Regulierung der Länge der Aktinfilamente, während die Titina an der Unterstützung und Verankerung von Myosinfilamenten in einer Region des als Linie M bekannten Sarkomeros teilnimmt.
Andere Proteine
Es gibt andere Proteine, die mit dicken Myofilamenten assoziiert sind, die als Protein C von Myosin und Miomesin Union bekannt sind, die für die Fixierung von Myosinfilamenten in Linie m verantwortlich sind.
Es kann Ihnen dienen: Unaporto: Transport durch Membranen, EigenschaftenFunktionen
Myofibrillen haben elementare Auswirkungen auf die Fähigkeit, Wirbeltiere zu bewegen.
Da sie aus faserigen und kontraktilen Proteinkomplexen des Muskelapparats bestehen, sind diese wichtig, um Reaktionen auf Nervenreize auszuführen, die zu Bewegung und Verschiebung führen (in den Skelettstreifenmuskeln).
Die unbestreitbaren dynamischen Eigenschaften des Skelettmuskels, die mehr als 40% des Körpergewichts umfassen.
Myofibrillen nehmen als Teil dieser Muskeln an all ihren Funktionen teil:
- Mechanik: Um chemische Energie in mechanische Energie umzuwandeln, um Festigkeit zu erzeugen, die Haltung aufrechtzuerhalten, Bewegungen zu erzeugen usw.
- Stoffwechsel: Da der Muskel am Basalenergiestoffwechsel beteiligt ist und als Speicherort grundlegender Substanzen wie Aminosäuren und Kohlenhydrate dient; Es trägt auch zur Herstellung von Hitze und Konsum von Energie und Sauerstoff bei, die bei körperlichen Aktivitäten oder Sportübungen verwendet werden.
Da Myofibrillen hauptsächlich aus Proteinen bestehen, stellen diese eine Speicher- und Freisetzungsstelle von Aminosäuren dar, die zur Aufrechterhaltung des Blutspiegels von Glukose während des Fastens oder Hungers beitragen.
Auch die Befreiung von Aminosäuren aus diesen Muskelstrukturen hat die Transzendenz aus Sicht der Biosynthesebedürfnisse anderer Gewebe wie Haut, Gehirn, Herz und anderen Organen.
Verweise
- Despoulos, a., & Silbernagl, s. (2003). Atlas der physiologischen Farbe (5. Aufl.). New York: Thieme.
- Friedman, a. L., & Goldman und. UND. (neunzehn sechsundneunzig). Mechanische Charakterisierung von Skelettmuskel -Myofibrillen. Biophysical Journal, 71(5), 2774-2785.
- Grenze, w. R., & Ochala, j. (2014). Skelettmuskel: Eine kurze Übersicht über Struktur und Funktion. Calcif Tissue Int, Vier fünf(2), 183-195.
- Goldspink, g. (1970). Die Proliferation von Myofibrillen während des Wachstums von Muskelfasern. J. Zellen -SCT., 6, 593-603.
- Murray, r., Bender, d., Botham, k., Kennelly, p., Rodwell, v., & Weil, p. (2009). Harpers illustrierte Biochemie (28. ed.). McGraw-Hill Medical.
- Rosen, J. N., & Baylies, m. K. (2017). Myofibrillen setzen die Kerne zusammen. Naturzellbiologie, 19(10).
- Sanger, j., Wangs, j., Fan und., Weiß, J., Mi-my, l., Dube, d.,... Pruyne, D. (2016). Montage und Wartung von Myofibrillen im Striat -Muskel. In Handbuch der experimentellen Pharmakologie (P. 37). New York, USA: Springer International Publishing Switzerland.
- Sanger, j. W., Wang, J., Fan und., Weiß, J., & Sanger, j. M. (2010). Montage und Dynamik von Myofibrillen. Zeitschrift für Biomedizin und Biotechnologie, 2010, 8.
- Sobieszek, a., & Bremel, r. (1975). Präparation und Eigenschaften von Wirbeltier glatt - Muskelmyofibrillen und Actomyosin. Europäisches Journal of Biochemistry, 55(1), 49-60.
- Villee, c., Walker, w., & Smith, f. (1963). Generalzoologie (2. Aufl.). London: w. B. Saunders Company.
- « Lobelieneigenschaften, Lebensraum, Verteilung, Arten
- Merkmale Cephalopoden, Lebensraum, Fortpflanzung, Ernährung »

