Myofilamente Typen, Struktur und Organisation
- 2442
- 72
- Luca Holdt
Der Myofilamente Sie sind die kontraktilen Proteine von Myofibrillen, die die strukturellen Einheiten von Muskelzellen, länglichen Zellen, die Muskelfasern genannt werden.
Muskelfasern und ihre Komponenten haben bestimmte Namen. Zum Beispiel sind Membran, Zytoplasma, Mitochondrien und endoplasmatisches Retikulum als Sarcolema, Sarkoplasma, Sarkosomen und sarkoplasmatisches Retikulum bekannt.
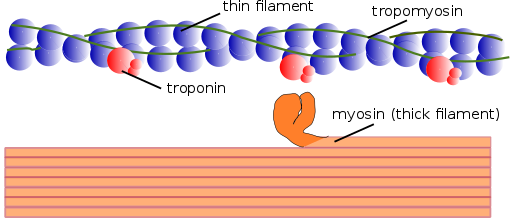
 Myofilamente Struktur (Quelle: Mikael Häggström, mit Permision verwendet. [Public Domain] über Wikimedia Commons)
Myofilamente Struktur (Quelle: Mikael Häggström, mit Permision verwendet. [Public Domain] über Wikimedia Commons) Ebenso werden die kontraktilen Elemente im Inneren zusammen Myofibrillen zusammengefasst; und die kontraktilen Proteine, aus denen sich Myofibrillen ausmachen, werden Myofilamente genannt.
Es gibt zwei Arten von Myofilamenten: dünne und Dicke. Dünne Filamente bestehen hauptsächlich aus drei Proteinen: Actin F, Tropomiosin und Troponin. Dicke Filamente bestehen inzwischen nur aus einem anderen Protein, der als Myosina II bekannt ist.
Darüber hinaus gibt es andere Proteine, die sowohl mit dicken als auch dünnen Filamenten assoziiert sind, aber diese haben keine kontraktilen Funktionen, wenn nicht eher struktur.
[TOC]
Arten von Muskelfasern
Die besondere Disposition von Myofilamenten, die Myofibrillen ausmachen.
Schicht Muskelfasern zeigen beim Untersuchung eines optischen Mikroskop. Es gibt zwei Arten von gestreiften Muskelfasern, Skelett und Herz.
Muskelfasern, die nicht zeigen, dass das Muster von Kreuzbändern als glatte Fasern bezeichnet wird. Sie sind diejenigen, die die Muskulatur von Gefäßwänden und Eingeweiden ausmachen.
Struktur
Dünne Myofilamente
Diese Myofilamente bestehen aus Actin F und zwei assoziierten Proteinen: Tropomiosin und Troponin, die regulatorische Funktionen haben.
Actin F oder filamentöser Actin ist ein Polymer aus einem anderen kleineren kugelförmigen Protein, das als Actin G oder globulärer Aktin bezeichnet wird, von etwa 42 kDa Molekulargewicht. Es verfügt über einen Gewerkschaftsort für Myosin und wird befohlen, zwei Ketten zu bilden, die als Doppelpropeller angeordnet sind.
Es kann Ihnen dienen: Proteolyse: Typen und FunktionenActin F -Filamente sind durch zwei Pole gekennzeichnet: eine positive, auf Disc Z gerichtet, und ein weiteres Negativ, das in die Mitte des Sarkomers angeordnet ist.
Tropomiosin besteht auch aus einer Doppelpropeller -Polypeptidkette. Es ist ein 64 kDa -Protein, das Filamente bildet, die sich in den Furchen befinden,.
In Ruhe deckt Tropomiosin die Gewerkschaftsstellen von Actin für Myosin ab oder verhindern die Wechselwirkung beider Proteine, was die Muskelkontraktion verursacht. Um jedes dünne Filament und etwa 25 oder 30ηm von Anfang jedes Tropomiosins ist ein weiteres Protein namens Troponin.
Troponin (TN) ist ein Proteinkomplex, der aus drei Untereinheiten von globulären Polypeptiden besteht, die als Troponin T, C und I bezeichnet werden. Jedes Tropomiosin -Molekül hat einen assoziierten Troponin -Komplex, der ihn reguliert, und zusammen sind sie für die Regulierung des Beginns und der Fertigstellung der Muskelkontraktion verantwortlich.
Dicke Myofilamente
Dicke Filamente sind Myosin -II -Polymere, die 510 kDa wiegen und durch zwei schwere Ketten von jeweils 222 kDa und vier leichte Ketten gebildet werden. Lichtketten sind zwei Arten: Essentielle Lichtketten, 18 kDa und regulatorische Lichtketten von 22 kDa.
Jede schwere Kette von Myosina II hat die Form eines Rohrrohrs mit einem kleinen kugelförmigen Kopf am Ende, der fast 90 ° C projiziert wird und zwei Fixierstellen enthält, eines für Actin und eines für die ATP. Deshalb gehören diese Proteine zur Familie Atasas.
Ein dickes Filament besteht aus mehr als 200 Myosin -II -Molekülen. Der kugelförmige Kopf eines jeden dieser Moleküle wirkt während der Kontraktion als "Rudern" und drängt den Aktin, an den es miteinander verbunden ist.
Organisation
In einer Skelettmuskelfaser belegen Myofibrillen den größten Teil des Sarkoplasma und sind in Längsschnitt und geordneten Sets in der gesamten Zelle angeordnet.
Kann Ihnen dienen: MitochondrienIn einem Längsschnittschnitt mit einem optischen Mikroskop, leichten Bändern namens Banden I und dunklen Bändern namens Banden A Bänder werden beobachtet. Diese Bänder entsprechen der ordnungsgemäßen Disposition von Myofibrillen und damit der Myofilamente, die sie zusammenstellen.
In der Mitte des Bandes I befindet sich eine dunkle und dünne Linie namens Line oder Disc Z. Das Zentrum jeder Band A präsentiert einen klareren Bereich, der als Band H bekannt ist, das zentral durch eine dunklere Linie namens M Line geteilt wird.
Zwischen zwei Z -Linien wird beschrieben, eine Struktur namens Sarkomer, die die funktionelle Einheit des Skelettmuskels ist. Ein Sarkomer besteht aus den kontraktilen Myofilamenten, die in den Bändern A, H und einem Hemi-Band I an jedem Ende angeordnet sind.
Bänder Ich habe nur dünne Filamente, das Band enthält dicke Filamente, die an ihren beiden Enden mit feinen Filamenten miteinander verflochten sind und die Band H nur dicke Filamente enthält.
Wie sind Myofilamente in Sarkomeren organisiert??
Bei der Untersuchung einer Skelettmuskelprobe am elektronischen Mikroskop können sowohl dicke Myofilamente als auch dünne Myofilamente beobachtet werden. Es wird gesagt, dass diese, die "interdign" oder "verbinden", in einer sequentiellen, ordentlichen und parallelen Disposition miteinander.
Die dünnen Filamente stammen aus den Z -Scheiben und erstrecken sich in die entgegengesetzte Richtung und in Richtung der Mitte jedes benachbarten Sarkomers. Von den Z -Scheiben an jedem Ende des Sarkomeros im entspannten Muskel erreicht der Aktin den Beginn der Band H auf jeder Seite.
So besetzen in den Muskelfasern des Skelettmuskels entspannte dicke Myofilamente den zentralen Bereich, der die dunklen Bänder oder Bänder A bildet; Und die dünnen Filamente erstrecken sich auf beiden Seiten des Sarkomers, ohne das Zentrum zu erreichen.
In einer Kreuzung in dem Bereich, in dem sich die dicken und dünnen Filamente überlappen Hexagon.
Kann Ihnen dienen: Simpleasto: Teile und EigenschaftenDiese Organisation von Myofilamenten im Sarkomer wird durch die Funktion einer Reihe von Protein erhalten, die mit Myofilamenten verbunden sind und die strukturelle Funktionen haben, darunter die Titin, das Alpha -Actin, das Nebulin, das Miomesin und das Protein C.
Kontraktionsmechanismus
Wenn Acetylcholin (ein Neurotransmitter) in der neuromuskulären Platte aufgrund der Stimulierung eines Motoneurons freigesetzt wird, wird die Muskelfasern angeregt und die spannungsabhängigen Calciumkanäle der sarkoplasmatischen Retikulos werden geöffnet.
Calcium bindet an Troponin c. Wenn der Kalziumspiegel sinkt, kehrt Tropomiosin in seine anfängliche Position zurück und die Kontraktion hört auf.
Die Exposition der Gewerkschaftsstellen des Actin mit Myosin ermöglicht es beiden Proteinen, sich mitzumachen und dass Myosin den Aktin in die Mitte des Sarkomers schob und über Myosin rutscht.
Während der Muskelkontraktion nähern sich die Z -Linien jedes Sarkomers in der Mitte, wobei sich die Linie M nähert, die Interdigitation zwischen Actin und Myosin erhöht und die Größe der Bänder I und H verringert. Der Grad der Verkürzung hängt von der Summe der Verkürzung der einzelnen Sarkomer des vertraglichen Muskels ab.
Verweise
- Berne, r., & Levy, m. (1990). Physiologie. Mosby; Internationale Ausgabe.
- Fox, s. Yo. (2006). Menschliche Physiologie (9. Aufl.). New York, USA: McGraw-Hill Press.
- Gartner, l., & Hiatt, j. (2002). Histology Atlas Text (2. Aufl.). Mexiko d.F.: McGraw-Hill Inter-American Editoren.
- Murray, r., Bender, d., Botham, k., Kennelly, p., Rodwell, v., & Weil, p. (2009). Harpers illustrierte Biochemie (28. ed.). McGraw-Hill Medical.
- Rawn, j. D. (1998). Biochemie. Burlington, Massachusetts: Neil Patterson Publishers.
- Ross, m., & Pawina, w. (2006). Histologie. Ein Text und Atlas mit korrelierter Zell- und Molekularbiologie (5. Aufl.). Lippinott Williams & Wilkins.
- West, J. (1998). Physiologische Grundlage der medizinischen Praxis (12ava ed.). Mexiko d.F.: Pan -American Medical Editorial.
- « Promielocito -Eigenschaften, Funktionen und Pathologien
- Giraffe -Eigenschaften, Lebensraum, Reproduktion, Lebensmittel »

