Myoglobin

- 1928
- 417
- Tizian Liebich
 Myoglobinstruktur
Myoglobinstruktur Was ist Myoglobin?
Der Myoglobin Es ist ein intrazelluläres globuläres Protein, das im Zytosol von Skelett- und Herzmuskelzellen gefunden wird. Seine grundlegende Funktion ist es, eine Sauerstoffreserve zu bilden und den intrazellulären Sauerstofftransport zu bevorzugen.
John Kendrew und Max Perutz erhielten 1962 den Nobelpreis für Chemie für ihre Studien zu kugelförmigen Proteinen. Diese Autoren erläutern die dreidimensionale Struktur von Myoglobin bzw. Hämoglobin. Historisch gesehen war Myoglobin eines der ersten Proteine, von denen die dreidimensionale Struktur bestimmt wurde.
Globuläre Proteine sind kompakte Moleküle mit kugelförmiger Form; Sie sind löslich in Cytosol oder im Lipidabschnitt von Zellmembranen. Sie sind für die wichtigsten biologischen Aktionen verantwortlich, im Gegensatz zu faserigen Proteinen, deren Hauptfunktionen strukturell sind.
Myoglobin gibt frisches Fleisch rot. Dies tritt auf, wenn Myoglobin als Oximioglobin und das Eisen, das es zusammenfasst.
Wenn das Fleisch der Umwelt ausgesetzt ist, Eisen, instabil, oxidiert und Eisen und unter diesen Bedingungen werden die Farbänderungen an Brauntönen für die Bildung von Metamioglobin (MB-FE3 + + O2 ●-).
Normalerweise sind die Blutniveaus MyGlobin sehr klein, sie sind in der Größenordnung von Mikrogramm pro Liter (μg/l). Diese Werte nehmen zu, wenn die Muskelzerstörung wie bei der Rhabdomyolyse des Skelettmuskels oder bei Herzinfarkt mit Gewebezerstörung und bei einigen Myopathien auftritt.
Sein Vorhandensein im Urin wird unter bestimmten Bedingungen beobachtet, unter denen Gewebeschäden sehr wichtig sind. Der frühe diagnostische Wert für Herzinfarkt ist umstritten.
Kann Ihnen dienen: Cell CoreMyoglobinstruktur
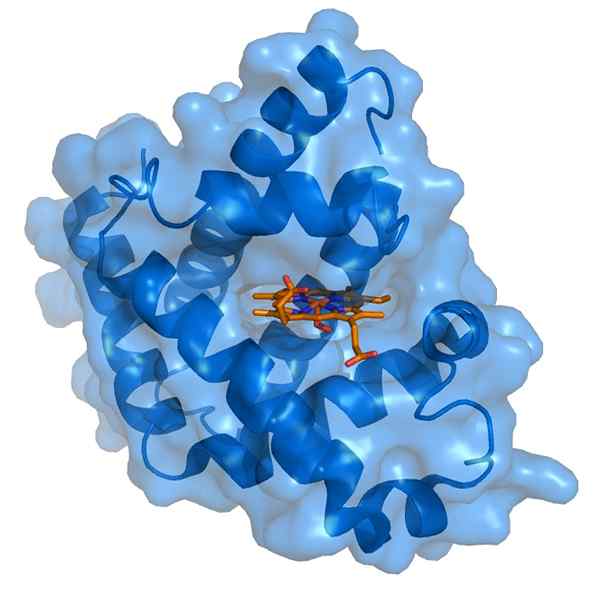 Myoglobin und seine Hämoprothesegruppe (Quelle: Thomas Spletttsser/CC BY-S (https: // CreePecommons.Org/lizenzen/by-sa/3.0) über Wikimedia Commons)
Myoglobin und seine Hämoprothesegruppe (Quelle: Thomas Spletttsser/CC BY-S (https: // CreePecommons.Org/lizenzen/by-sa/3.0) über Wikimedia Commons) Myoglobin hat ein Molekulargewicht von fast 18 kDa, einschließlich der HEMO -Gruppe. Es besteht aus vier helikalen Segmenten, die durch "plötzliche Kurven" vereint sind. Diese Myoglobin -Propeller sind eng verpackt und halten ihre strukturelle Integrität, selbst wenn die HEMO -Gruppe entfernt wird.
Die Struktur von globulären Proteinen sowie alle Zellproteine ist hierarchisch, daher ist die Struktur des Myoglobins auch. Die erste Ebene ist die Primärstruktur, die durch die lineare Sequenz von Aminosäuren gebildet wird, und Myoglobin besteht aus einer 153 Aminosäurekette.
Die sekundäre Struktur des Myoglobins besteht in der Bildung von Alpha -Propeller. Myoglobin enthält 8 Alpha -Propeller, die durch wiederholte Polypeptid -Teile gebildet werden, die durch kurze aperiadische Managementsegmente binden.
Die tertiäre Struktur besteht aus einer dreidimensionalen Konformation mit biologischer Aktivität. Die wichtigsten Eigenschaften dieser Struktur sind die Faltung. Die quaternäre Struktur bezieht sich auf die Zusammenstellung von zwei oder mehr separaten und vereinten Polypeptidketten durch nichtkovalente Verbindungen oder Wechselwirkungen.
Myoglobin hat eine sehr kompakte Struktur mit hydrophoben Abfällen, die in die innere, hydrophile oder polare Rückstände nach außen gerichtet sind. Interner apolarer Abfall wird durch Leucin, Valin, Methode und Phenylalanin gebildet. Der einzige interne polare Abfall sind zwei Histidine, die Funktionen im aktiven Zentrum haben.
Die Hämoprothesegruppe befindet sich in einer Spalte des apolaren inneren Teils der Polyloglobin -Polypeptidkette. Diese Gruppe enthält Eisen in Form von Eisen Eisen, das an Sauerstoff bindet, um Oximioglobin zu bilden.
Kann Ihnen dienen: GLUT4: Eigenschaften, Struktur, FunktionenMyoglobinfunktion
Die Funktion von Myoglobin besteht darin, den Sauerstoff der Hämogruppe ihrer Struktur zu vereinen und eine Sauerstoffreserve für die Muskelfunktion zu bilden. In dem Maße, in dem Sauerstoff in der Struktur von Myoglobin im Zytoplasma der Muskelzelle eingeschlossen ist, bleibt ihr intrazellulärer Druck, der durch freien Sauerstoff bestimmt wird.
Der niedrige intrazelluläre Sauerstoffdruck hält den Gradienten für den Sauerstoffeinlass in die Zelle. Dies begünstigt den Durchgang von Sauerstoff aus dem Kreislauf zur Muskelzelle. Wenn Myoglobin sättigt intrazellulär.
Die Sauerstoffbindungskurve an Myoglobin ist hyperbolisch. In den anfänglichen Teilen der Kurve erzeugen kleine Veränderungen im partiellen Sauerstoffdruck große Veränderungen in der Sättigung von Myoglobin mit Sauerstoff.
In dem Maße, in dem der teilweise Sauerstoffdruck die Sättigung zunimmt.
Es gibt eine Variable, die die Affinität der Kurve namens P50 misst. Dies stellt den Teildruck des Sauerstoffs dar, der zur Sättigung des in einer Lösung enthaltenen Myoglobins um 50% erforderlich ist. Wenn der P50 zunimmt, wird gesagt, dass Myoglobin weniger Affinität hat und wenn der P50 abnimmt.
Kann Ihnen dienen: Proeritroblast: Merkmale, Morphologie, Regulierung, FärbungWenn die Sauerstoffbindungskurven mit Myoglobin und Hämoglobin untersucht werden.
Arten von Muskelfasern und Myoglobin
Die Skelettmuskeln haben unterschiedliche Arten von Muskelfasern in ihrer Zusammensetzung, einige langsame Kontraktionsaufrufe und andere von schneller Kontraktion. Schnelle Kontraktionsfasern sind strukturell und metabolisch an die schnelle und kräftige und energische und anaeroben Weise angepasst.
Langsame Kontraktionsfasern sind für niedrige Verschiebung angepasst, aber längere Kontraktionen, die für aerobe Widerstandsübungen typisch sind. Einer der strukturellen Unterschiede dieser Fasern ist die Konzentration von Myoglobin, die ihnen den Namen weißer und roter Fasern gibt.
Rote Fasern haben einen hohen Myoglobingehalt, der ihnen rote Farbe verleiht, die es ihnen aber auch ermöglicht, große Mengen an Sauerstoff aufrechtzuerhalten, was für ihre Funktion unverzichtbar ist.
Normalwerte
Normale Blutwerte für Männer sind 19 bis 92 µg/l und bei Frauen von 12 bis 76 µg/l, es gibt jedoch Unterschiede in den Werten in verschiedenen Labors.
Diese Werte nehmen zu, wenn die Muskelzerstörung wie bei der Rhabdomyolyse des Skelettmuskels, in ausgedehnten Verbrennungen, Elektroschocks oder in einer ausgedehnten Muskelnekrose aufgrund arterieller Okklusion, bei Myokardinfarkt und bei einigen Myopathien auftritt.
Unter diesen Bedingungen erscheint Myoglobin im Urin und gibt ihm eine charakteristische Farbe.

