Aktuelles Atommodell

- 1945
- 176
- Rieke Scheer
Was ist das aktuelle Atommodell??
Er Aktuelles Atommodell Es ist diejenige, die auf der Quantenmechanik basiert, insbesondere in der Schrödinger -Gleichung, im Prinzip des Ausschlusses von Pauli und einer Eigenschaft des Elektrons genannt drehen entweder Espin.
Es ist das Modell der größten Akzeptanz und Verwendung in der Untersuchung der Struktur von Atomen, Molekülen und in der chemischen Reaktivität der Elemente aufgrund der Präzision ihrer Vorhersagen und ihrer relativen Einfachheit.
 Abbildung 1. Wasserstoffatom in einem angeregten Zustand und seiner Atomzahlen: Energie N = 4, Winkelimpuls L = 3 und Magnetmoment m = 1. Quelle: Wikimedia Commons.
Abbildung 1. Wasserstoffatom in einem angeregten Zustand und seiner Atomzahlen: Energie N = 4, Winkelimpuls L = 3 und Magnetmoment m = 1. Quelle: Wikimedia Commons. Dieses Modell ist die Entwicklung mehrerer früherer Atommodelle, wie das Rutherford -Modell und das von Bohr - Sommerfeld, als klassische oder halbklassische Modelle angesehen.
Derzeit gibt es theoretisch vollständige Modelle als das typisische Modell von Schrödinger, wie das Dirac-Jordan-Modell, das eine spezielle Relativitätstheorie umfasst und auf der Dirac-Wellengleichung basiert. In dieser Gleichung erscheint der Spin, die Eigenschaft der zu Beginn genannten Elektronen.
Es gibt auch Modelle, die auf der Quantenfeldtheorie basieren, die in einer Hochenergiephysik angewendet werden. Diese Modelle sind hervorragend in der Vorhersage der Schöpfung und Vernichtung von grundlegenden Partikeln, dem Ziel dieses Bereichs der Physik.
Es ist erwähnenswert, dass die anspruchsvollsten Theorien zu den gleichen Ergebnissen wie die der Schrödinger -Gleichung konvergieren, insbesondere für leichte Atome.
Aktuelle Atommodelleigenschaften
In der Vision des aktuellen Atom.
Das am weitesten verbreitete Bild des Atom. Trotz seiner Wurzeln entspricht es dem aktuellen Atommodell nicht mehr.
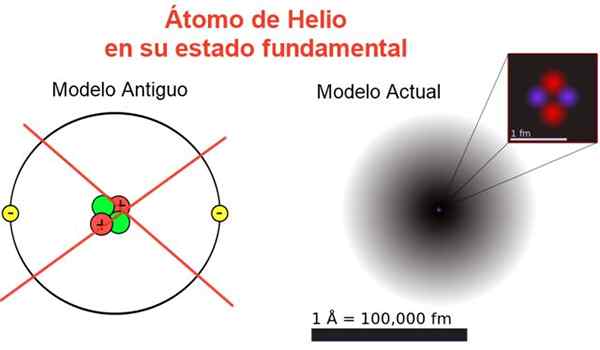 Figur 2. Klassisches und aktuelles Bild des Heliumatoms in seinem grundlegenden Zustand. Im aktuellen Modell sind die beiden Elektronen des Heliumatoms in einer Region bezeichnet, die als Orbital bezeichnet wird. Quelle: Wikimedia Commons, Ihre eigene Komposition.
Figur 2. Klassisches und aktuelles Bild des Heliumatoms in seinem grundlegenden Zustand. Im aktuellen Modell sind die beiden Elektronen des Heliumatoms in einer Region bezeichnet, die als Orbital bezeichnet wird. Quelle: Wikimedia Commons, Ihre eigene Komposition. Abbildung 2 zeigt das alte Bild und das aktuelle Bild eines Heliumatoms in seinem kleineren Energiezustand (Stufe N = 1 und L = 0).
Es kann Ihnen dienen: Durchschnittliche Beschleunigung: Wie es berechnet und gelöst wirdDas klassische Bild ist nützlich zu sehen, dass der Kern zwei Protonen und zwei Neutronen enthält. Mit der Gewährleistung der Neutralität des Atom.
Aus dem Rest ist es ein Bild weg von der Realität entfernt, da der Skala des Kerns nicht einmal dem des Atoms entspricht: Der Kern beträgt 1/100000 -mal so groß wie die Größe des Atoms, aber dort ist die Atommasse konzentriert.
Onda Dualität - Partikel
Die klassische Mechanik legt fest, dass jedes materielle Partikel eine zugehörige Welle hat, genannt Wellenfunktion. Dies ist der Berühmte Onda-Partikel-Dualität aus Louis de Broglie.
Im aktuellen Atommodell ist das Verhalten des Elektrons auf der Skala der Atome prominent wellig, während auf makroskopischer Ebene, wie beispielsweise die Elektronen, die sich in den Kathodenstrahlröhren der alten Fernseher bewegen, das korpuskuläre Verhalten vorherrscht.
Andererseits geschieht es mit Photonen im Gegenteil, in den meisten optischen Phänomen. Und wenn sie mit Materie interagieren, haben sie ein Partikelverhalten.
Aus diesem Grund werden Elektronen um den Kern in Bereiche verteilt, die genannt werden atomare Orbitale, deren Form und Ausdehnung abhängen vom Energieniveau der Elektronen und dem Winkelimpuls.
Sowohl Energie als auch der Winkelimpuls des Elektrons um den Kern haben bestimmte zulässige Werte, daher wird gesagt, dass sie es sind quantisiert.
Die Schrödinger -Wellengleichung sagt voraus, welche Energiewerte und Winkelimpuls sowie die Wellenfunktion, die mit jeder Energie- und Impuls -Ebene verbunden ist.
Das mathematische Quadrat der Wellenfunktion bestimmt die Orbitale, dh die Bereiche um den Kern, in denen Elektronen wahrscheinlicher sind.
Die Atomgröße
Um ein Skalenbild des aktuellen Atommodells zu haben, stellen wir uns vor, dass ein Atom einen Durchmesser wie das eines Fußballfeldes hat. Der Kern wäre wie eine Ameise in der Mitte des Feldes, aber überraschenderweise mit 99,9% der Atommasse.
Andererseits wären Elektronen ebenso diffuse geisterhafte Spieler im gesamten Feld, was eine größere Wahrscheinlichkeit, im Mittelfeld zu finden.
Kann Ihnen dienen: Kategorische Variable: Merkmale und BeispieleEs gibt einige Ausrichtungen oder erlaubte Möglichkeiten, das Feld zu besetzen, die von der Energie der Spieler (Elektronen) und der Menge an „Drehung“ oder Drehen in der Mitte abhängen.
Aktuelle Atommodell postuliert postuliert
1.- Das Elektron ist durch seine Masse m durch seinen Dreh gekennzeichnet S Und um das elementare negative Lastträgerpartikel (-e) zu sein.
2.- Die Elektro.
3.- Die Elektronen umgeben den positiven Atomkern, so dass sie die elektrische Neutralität des Atoms garantieren. Daher entspricht die Menge der Elektronen der von Protonen; Dies ist das Ordnungszahl, Das verleiht die chemischen und physikalischen Eigenschaften jedes Elements.
4.- Die Wechselwirkung zwischen Elektronen und Kern wird durch potenzielles V modelliert (R) Coulombs Elektrostatische, die in den Laufzeitenpotentialenergie im Hamiltonschen Betreiber einbezogen wird.
5.- Der Begriff der kinetischen Energie im Hamiltonschen Bediener ist ein Bediener, der aus dem linearen Impuls -Operator gebaut wird und der gleiche ist:
P = - i ħ ∂ /∂R
Wobei ħ Plancks Konstante geteilt durch 2π ist.
6.- Der Hamiltonsche Operator H = (Púp)/2m - e v (R) auf die Elektronenwellenfunktion ψ (R).
7.- Da die stationären Lösungen der elektronischen Wellenfunktion gesucht werden, wird die unabhängige Schrödinger -Zeitgleichung verwendet:
H ψ (R) = E ψ (R)
Wobei E die Gesamtenergie des Elektrons darstellt.
8.- In Atomen mit mehreren Elektronen wird die Wechselwirkung zwischen ihnen nicht berücksichtigt.
9.- Wenn es um Atome vieler Elektronen geht, werden die Orbitale der äußersten Elektronen durch das Potenzial des abgeschirmten Kerns durch die meisten internen Elektronen modelliert.
10.- Gleichung (7) hat eine Lösung für einige diskrete Energiewerte, damit Prominente Wie viele von Planck, Sie treten natürlich aus Schrödinger's Gleichungslösungen auf.
Es kann Ihnen dienen: Stationäre Wellen: Formeln, Eigenschaften, Typen, Beispieleelf.- Für jeden diskreten Wert gibt es eine Wellenfunktion. Einige Lösungen sind jedoch abhängig vom Wert des Winkelimpulses l degeneriert.
12.- Die Wellenfunktion ist das Produkt einer radialen Funktion, der azimutalen Funktion und der polaren Funktion.
13.- Diese Wellenfunktion bestimmt die zulässigen Regionen für das Elektron. Das Quadrat der Wellenfunktion ist die Wahrscheinlichkeitsdichte Um das Elektron in einer bestimmten Position zu finden, aus der Mitte des Atomkerns gesehen.
14.- Der Spin erscheint nicht in der Schrödinger -Gleichung, sondern wird durch das Pauli -Prinzip in das Atommodell aufgenommen:
Das Elektron ist ein Fermion mit zwei möglichen Zuständen von Spin +½ und -½.
Der gleiche Zustand, der durch Quantenzahlen N, L, m der Schrödinger -Gleichung gekennzeichnet ist, kann höchstens von 2 Elektronen mit Gegensätzen gegen Gegensätze besetzt werden. Auf diese Weise wird das ESPIN zur vierten Quantenzahl.
Einflussreiche Wissenschaftler im aktuellen Atommodell
Es scheint unglaublich, aber die meisten Physiker, die zum aktuellen Atommodell beigetragen haben. Sie versammelten sich in den berühmten Konferenzen, die von Ernest Solvay, einem Chemiker und Industrie belgischer Herkunft, gesponsert wurden, der in der Welt der Wissenschaft berühmt wurde.
Sie begannen seit 1911, die größten Wissenschaftler des Augenblicks zusammenzubringen, darunter auch alle, die ihren Beitrag zum aktuellen Atommodell legten.
Die berühmteste dieser Konferenzen fand 1927 in Brüssel statt und dort wurde dieses historische Foto aufgenommen:
 Figur 3. 1927 Teilnehmer der Solvay -Konferenz in Brüssel. Quelle: Wikimedia Commons.
Figur 3. 1927 Teilnehmer der Solvay -Konferenz in Brüssel. Quelle: Wikimedia Commons.  Figur 4. Die Teilnehmer der Solvay -Konferenz von 1927.
Figur 4. Die Teilnehmer der Solvay -Konferenz von 1927. - Peter Debye
- Irving Langmuir
- Martin Knudsen
- Auguste Piccard
- Max Planck
- William Lawrence Bragg
- Émile Henriot
- Paul Ehrenfest
- Marie Curie
- Hendrik Anthony Kramers
- Édouard herzen
- Hendrik Antoon Lorentz
- Donder Théophile
- Paul Adrien Maurice Dirac
- Albert Einstein
- Erwin Schrödinger
- Arthur Holly Compton
- Jules-temile Verschaffelt
- Paul Langevin
- Louis-Victor de Broglie
- Charles-Eugène Guye
- Wolfgang Pauli
- Werner Heisenberg
- Max geboren
- Charles Thomson Rees Wilson
- Ralph Howard Fowler
- Léon Billouin
- Niels Bohr
- Owen Williams Richardson
Artikel von Interesse
Schrödinger Atommodell.
Broglie Atomic Model.
Chadwick Atomic Model.
Heisenberg Atomic Model.
Perrin Atommodell.
Thomson Atomic Model.
Dalton Atomic Model.
Dirac Jordan Atomic Model.
Democritus Atomic Model.
Leucipo -Atommodell.
BOHR -Atommodell.
Verweise
- Alonso - Finn. Quanten- und statistische Grundlagen. Addison Wesley.
- Bauer, w. 2011. Physik für Ingenieurwesen und Wissenschaften. Band 1. Mc Graw Hill.
- Eisberg und Resnick. Quantenphysik. Limusa - Wiley.
- Wikipedia. Atomtheorie. Geborgen von: ist.Wikipedia.com
- Zapata f. Typokuantikmodell des Atoms. Abgerufen von: Lifer.com

