BOHR -Atommodell
- 4615
- 15
- Ibrahim Steuk
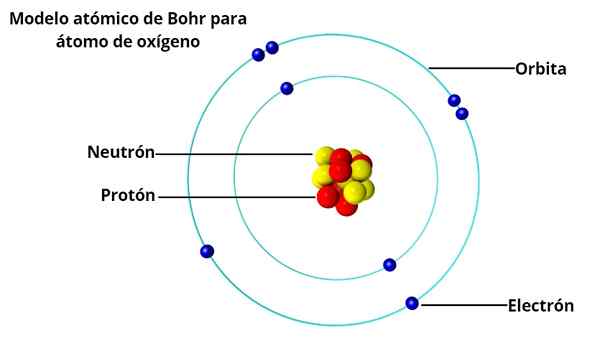
Er BOHR -Atommodell Es ist die Konzeption des dänischen Physikers Niels Bohr (1885-1962) über die Struktur des Atoms, die 1913 veröffentlicht wurde. Im Bohratom belegen Elektronen um den Kern nur bestimmte zulässige Umlaufbahnen dank einer Beschränkung, die genannt wird Quantisierung.
Für Bohr, das Bild des Atoms als Miniatur -Sonnensystem mit Elektronen, indem es um den Kern umkreist, stimmte es nicht vollständig mit der Tatsache überein, dass elektrische Ladungen, wenn sie beschleunigt werden, Energie ausstrahlen, Energie ausstrahlen, die Energie ausstrahlen.

Ein solches Atom wäre nicht stabil, da es früher oder später einstürzen würde, weil die Elektronen spirituell zum Kern ausfallen würden. Und bis dahin, vor 50 Jahren.
Das Muster oder das Spektrum besteht aus einer Reihe heller Linien bestimmter sehr spezifischer Wellenlängen. Und das Wasserstoffatom kollabiert nicht durch Emission von Licht.
Um zu erklären, warum das Atom stabil ist, obwohl er in der Lage ist, elektromagnetische Energie auszustrahlen. Dies wird durch Quantisierung verstanden.
Das Annehmen, dass die Energie quantisiert wurde, hätte das Elektron die notwendige Stabilität, um nicht auf den Kern zu eilen, der das Atom zerstört.
Und das Atom strahlt nur Lichtenergie aus, wenn das Elektron von einer Umlaufbahn zur anderen Übergänge durchführt, immer in diskreten Mengen. Auf diese Weise wird das Vorhandensein von Emissionsmustern in Wasserstoff erklärt.
Bohr komponiert auf diese Weise eine Vision des Atoms, das bekannte Konzepte der klassischen Mechanik in die neu entdeckten, wie Plancks Konstante, das Photon, das Elektron, der Atomkern (Rutherford war ein Mentor von Bohr gewesen) und das vorgenannte Spektrat der Ausgabe integriert.
[TOC]
Hauptmerkmale des Bohr -Modells
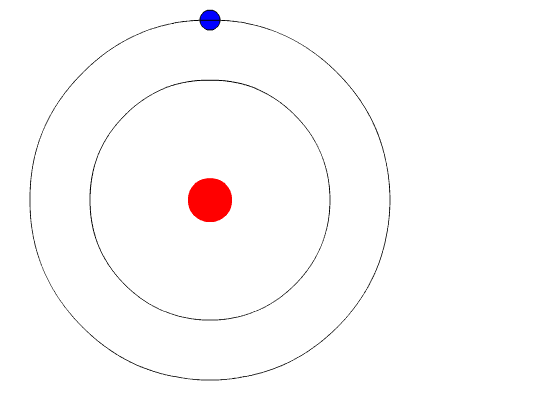 Bohrs Atom. Die Animation repräsentiert das Elektron, wenn es von einem höheren Energieniveau zu einem anderen weniger Energie wechselt und ein Licht des Lichts ausgibt (ein Photon). Quelle: Wikimedia Commons.
Bohrs Atom. Die Animation repräsentiert das Elektron, wenn es von einem höheren Energieniveau zu einem anderen weniger Energie wechselt und ein Licht des Lichts ausgibt (ein Photon). Quelle: Wikimedia Commons. Das Atommodell von Bohr geht davon aus, dass sich das Elektron in einer kreisförmigen Umlaufbahn um den Kern um den Kern bewegt.
Kann Ihnen dienen: Vektor ausbalancieren: Berechnung, Beispiele, ÜbungenLassen Sie uns sehen, wie beide Konzepte in mathematische Form integriert werden:
Sei l die Größe des Winkelimpulses, m die Masse des Elektrons und die Geschwindigkeit des Elektrons und r den Radius der Umlaufbahn. Um l zu berechnen, haben wir:
L = m · Rash
Bohr schlug vor, dass L gleich Multiples der konstanten h/2π war, wobei H das ist Planck konstant, Vor kurzem vom Physiker Max Planck (1858-1947) zur Lösung des von einem schwarzen Körper emittierten Energieproblems eingeführt, ein theoretisches Objekt, das das gesamte einfallende Licht absorbiert.
Sein Wert ist H = 6.626 × 10–34 J ・ s, während es bei h/2π als bezeichnet wird als als H, Das liest "H Bar".
Daher bleibt der Winkelimpuls l bleibt:
m Organ = nH, Mit n = 1,2, 3 ..
Und aus diesem Zustand werden die Radios der für das Elektron zugelassenen Umlaufbahnen abgeleitet, wie wir dann sehen werden.
Berechnung des Elektronen -Orbit -Radius
Im Folgenden werden wir die einfachsten Atome annehmen: Wasserstoff, das aus einem einzelnen Proton und einem Elektron besteht, beide mit einer Größenlast und.
Die zentripetale Kraft, die das Elektron in seiner kreisförmigen Umlaufbahn hält, wird durch elektrostatische Anziehung bereitgestellt, deren Größe F ist:
F = ke2/R2
Wobei K die elektrostatische Konstante des Coulomb- und R-Gesetzes ist, der Elektron-Protein-Abstand. Wissen, dass in einer kreisförmigen Bewegung die ZentripetalbeschleunigungC Es wird durch Vernunft zwischen dem Quadrat von Geschwindigkeit und Entfernung R gegeben: R:
ZuC = v2 / R
Nach Newtons zweitem Gesetz ist Net Force das Produkt der Masse M durch Beschleunigung:
MV2/r = ke2/R2
Vereinfachung von Radio R wird erhalten:
Morben2R = ke2
Kombinieren Sie diesen Ausdruck mit dem des Winkelimpulses, wir haben ein Gleichungssystem, das durch:
Es kann Ihnen dienen: Physische Flugbahn: Eigenschaften, Typen, Beispiele und Übungen1) MV2R = ke2
2) r = n H/MV
Die Idee ist, das System zu lösen und R, den Radius der zulässigen Umlaufbahn zu bestimmen. Eine kleine Elementaralgebra führt zur Antwort:
R = (nH)2 / Koge2
Mit n = 1, 2, 3, 4, 5 ..
Für n = 1 haben wir das geringste Radios, genannt Bohr Radio aentweder Mit einem Wert von 0,529 × 10–10 M. Die Funkgeräte der anderen Umlaufbahnen werden in Bezug auf Zuentweder.
Auf diese Weise stellt Bohr die Hauptquantenzahl ein N, Hinweis darauf, dass die zulässigen Radios auf der Planck -Konstante, der elektrostatischen Konstante und der Masse und Last des Elektrons basieren.
Bohr Atomic Model postuliert postuliert
 Dänischer Physiker Niels Bohr (1885-1962).
Dänischer Physiker Niels Bohr (1885-1962). Bohr kombiniert geschickt die Newtonschen Mechanik mit den neuen Entdeckungen, die in der zweiten Hälfte des 19. Jahrhunderts und zu Beginn des 20. Jahrhunderts kontinuierlich gegeben hatten. Unter ihnen das revolutionäre Konzept von "wie viel", von dem Planck selbst behauptete, nicht sehr überzeugt zu sein.
Durch seine Theorie konnte Bohr die Reihe des Wasserstoffspektrums zufriedenstellend erklären und Energieemissionen im Rang des Ultravioletten und des Infrarots vorhersagen, die noch nicht beobachtet worden waren.
Wir können Ihre Postulate wie folgt zusammenfassen:
Elektronen beschreiben kreisförmige Trajektorien
Das Elektron dreht sich um den Kern in einer stabilen kreisförmigen Umlaufbahn mit gleichmäßiger kreisförmiger Bewegung. Die Bewegung ist auf die elektrostatische Anziehungskraft zurückzuführen, die der Kern darauf ausübt.
Der Winkelimpuls wird quantisiert
Der Winkelimpuls des Elektrons wird gemäß dem Ausdruck quantisiert:
L = mvr = nH
Wobei n eine Ganzzahl ist: n = 1, 2, 3, 4 ..., was zum Elektron führt, kann nur in bestimmten definierten Umlaufbahnen sein, deren Radios:
R = (n H)2 / k m e2
Elektronen emittieren oder absorbieren Photonen, wenn sie sich von einem Energiezustand zum anderen bewegen
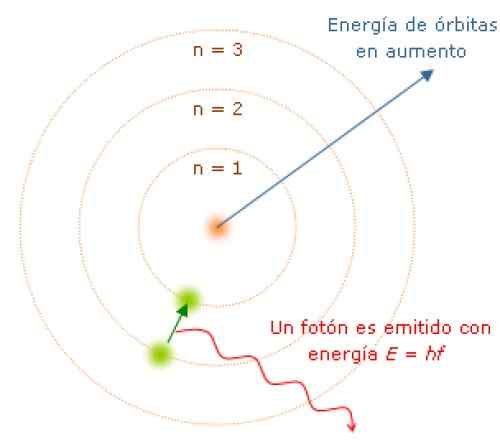
 Wenn sich das Elektron von einem Energiezustand zum anderen bewegen, nimmt das Elektron Energie in diskreten Mengen auf, die als Photonen bezeichnet werden. Quelle: Wikimedia Commons.
Wenn sich das Elektron von einem Energiezustand zum anderen bewegen, nimmt das Elektron Energie in diskreten Mengen auf, die als Photonen bezeichnet werden. Quelle: Wikimedia Commons. Da ist der Winkelimpuls quantisiert, Energie und auch. Es kann gezeigt werden, dass E gegeben wird durch:
Kann Ihnen dienen: Vertikaler Schuss: Formeln, Gleichungen, Beispiele
Das Volt -Elektron oder EV ist eine weitere Einheit für Energie, die in der Atomphysik weit verbreitet ist. Das negative Energiezeichen sorgt für die Stabilität der Umlaufbahn, was darauf hinweist, dass Arbeiten durchgeführt werden sollten, um das Elektron von dieser Position zu trennen.
Während sich das Elektron in seiner Umlaufbahn befindet. Aber wenn es von einer Umlaufbahn mit größerer Energie zu einem niedrigeren springt, das es tut.
Die Frequenz f des emittierten Lichts hängt von der Differenz zwischen den Energieniveaus der Umlaufbahnen ab:
E = hf = eInitial - eFinale
Einschränkungen
Das Bohr -Modell hat bestimmte Einschränkungen:
-Es gilt nur erfolgreich für das Wasserstoffatom. Versuche, es auf komplexere Atome anzuwenden, funktionierten nicht.
-Es antwortet nicht, warum einige Umlaufbahnen stabil sind und andere nicht. Die Tatsache, dass die Energie im Atom quantisiert wurde.
-Eine weitere wichtige Einschränkung besteht darin, dass die zusätzlichen Linien, die Atome in Gegenwart elektromagnetischer Felder ausgestellt haben (Zeeman -Effekt und starker Effekt), nicht erklärt wurden. Oder warum einige Spektrumlinien intensiver waren als andere.
-Das Bohr -Modell berücksichtigt nicht relativistische Effekte, was notwendig ist.
-Es dauert selbstverständlich, dass es möglich ist, genau die Position und Geschwindigkeit des Elektrons zu kennen, aber was wirklich berechnet wird, ist die Wahrscheinlichkeit, dass das Elektron eine bestimmte Position einnimmt.
Trotz seiner Einschränkungen hatte das Modell zu dieser Zeit große Erfolg, nicht nur für die Integration neuer Entdeckungen mit bereits bekannten Elementen, sondern weil es neue Fragen zeigte, was deutlich machte, dass der Weg zu einer zufriedenstellenden Erklärung des Atoms in der Quantenmechanik war.
Artikel von Interesse
Schrödinger Atommodell.
Broglie Atomic Model.
Chadwick Atomic Model.
Heisenberg Atomic Model.
Perrin Atommodell.
Thomson Atomic Model.
Dalton Atomic Model.
Dirac Jordan Atomic Model.
Democritus Atomic Model.
Leucipo -Atommodell.
Sommerfeld Atommodell.
Aktuelles Atommodell.


