Broglie Atomic Model

- 5137
- 308
- Tizian Liebich
Er Broglie Atomic Model Es wurde 1924 vom französischen Physiker Louis Broglie vorgeschlagen. In seiner Doktorarbeit sagte Broglie, die Wellenpartikel-Dualität von Elektronen, die die Grundlagen der welligen Mechanik legte. Broglie veröffentlichte wichtige theoretische Erkenntnisse über Wellencorpusculus Nature.
Anschließend wurden Broglies Aussagen 1927 von den Wissenschaftlern Clinton Davisson und Lester Germer experimentell demonstriert. Die Wellenentheorie der Broglie -Elektronen basiert auf Einsteins Vorschlag für die undulatorischen Eigenschaften von Licht in kurzen Wellenlängen.
 Louis Broglie
Louis Broglie Broglie kündigte die Möglichkeit an, dass Materie ein ähnliches Verhalten wie Licht hatte, und schlug ähnliche Eigenschaften in subatomaren Partikeln wie Elektronen vor.
Elektrische und Umlaufbahnlasten beschränken die Amplitude, Länge und Frequenz der durch Elektronen beschriebenen Welle. Broglie erklärte die Bewegung von Elektronen rund um den Atomkern.
[TOC]
Eigenschaften des Atommodells von Broglie
Um ihren Vorschlag zu entwickeln, startete Broglie von dem Prinzip, dass Elektronen eine doppelte Natur zwischen Welle und Teilchen hatten, ähnlich wie das Licht.
In diesem Sinne machte Broglie ein Gleichnis zwischen den beiden Phänomenen und basierend auf den von Einstein entwickelten Gleichungen für die Untersuchung der welligen Natur des Lichts: Folgendes:
- Die Gesamtenergie des Photons und folglich die Gesamtenergie des Elektrons resultiert aus dem Produkt der Wellenfrequenz und der Plankenkonstante (6.62606957 (29) × 10 -3. 4 Jules x Sekunden), wie im folgenden Ausdruck beschrieben:

In diesem Ausdruck:
E = Elektronenergie.
H = Plankenkonstante.
F = Wellenfrequenz.
- Das lineare Moment des Photons und damit des Elektrons ist umgekehrt proportional zur Länge der Welle, und beide Größen sind durch die Plankenkonstante zusammengefasst:
Kann Ihnen dienen: Umkehrosmose: Wie es funktioniert, wofür es ist, Beispiele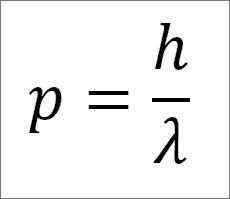
In diesem Ausdruck:
P = lineares Moment des Elektrons.
H = Plankenkonstante.
λ = Wellenlänge.
- Das lineare Moment ist das Produkt der Masse des Partikels aufgrund der Geschwindigkeit, die das Teilchen während seiner Verschiebung hat.
Wenn der vorherige mathematische Ausdruck in Abhängigkeit von der Wellenlänge umstrukturiert wird, lautet Folgendes:
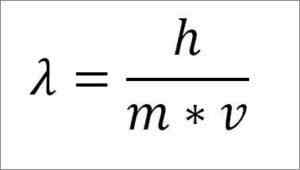
In diesem Ausdruck:
λ = Wellenlänge.
H = Plankenkonstante.
M = Elektronenmasse.
V = Elektronengeschwindigkeit.
Da die Plankenkonstante einen kleinen Wert hat, ist die Wellenlänge λ auch. Folglich ist es möglich zu sagen, dass die Welleneigenschaften des Elektrons nur auf atomarer und subatomarer Ebene dargestellt werden.
- Broglie basiert auch auf den Postulaten des Bohr Atomic -Modells. Letzteres zufolge sind die Umlaufbahnen der Elektronen begrenzt und können nur ein Vielfaches der ganzen Zahlen sein. So:
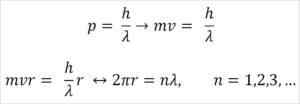
Wo:
λ = Wellenlänge.
H = Plankenkonstante.
M = Elektronenmasse.
V = Elektronengeschwindigkeit.
R = Orbit Radius.
n = ganze Zahl.
Laut Bohrs Atommodell, dem Broglie als Basis übernommen hat, sind die einzigen erlaubten Umlaufbahnen diejenigen, deren Radius gleich ein ganzes Vielfalt der Wellenlänge λ ist, wenn sich die Elektronen als stationäre Wellen verhalten.
Daher entsprechen nicht alle Umlaufbahnen den erforderlichen Parametern für ein Elektron, um diese durch diese zu mobilisieren. Hier ist der Grund, warum sich Elektronen nur in bestimmten Umlaufbahnen bewegen können.
Die Wellenentheorie von Broglies Elektronen rechtfertigte den Erfolg von Bohrs Atommodell, um das einzigartige Elektronenverhalten des Wasserstoffatoms zu erklären.
Kann Sie servieren: Trockener BatterieIn ähnlicher Weise gab er auch Lichter darauf, warum sich dieses Modell nicht an komplexere Systeme anpasste, dh Atome mit mehr als einem Elektron.
Davisson und Germer Experiment
Die experimentelle Überprüfung des Atommodells von Broglie fand 3 Jahre später von seiner Veröffentlichung 1927 statt.
Die prominenten US -Physiker Clinton J. Davisson und Lester Germer bestätigten experimentell die Theorie der welligen Mechanik.
Davisson und Germer führten Dispersionstests eines Elektronenstrahls durch einen Nickelkristall durch und beobachteten das Phänomen der Beugung durch die metallische Umgebung.
Das durchgeführte Experiment bestand aus der Ausführung des folgenden Verfahrens:
- In erster Linie wurde eine Baugruppe mit Elektronenstrahl platziert, die eine bekannte anfängliche Energie hatte.
- Es wurde eine Spannungsquelle installiert, um die Elektronenbewegung zu beschleunigen, die eine Potentialdifferenz anregt.
- Der Fluss des Elektronenstrahls zu einem metallischen Glas wurde gerichtet; In diesem Fall Nickel.
- Die Anzahl der Elektronen, die auf das Nickelglas trafen.
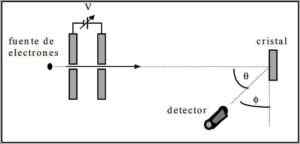
Am Ende des Experimentierens stellten Davisson und Germer fest, dass sich die Elektronen in verschiedene Richtungen verteilten.
Bei der Wiederholung des Experiments unter Verwendung von Metallkristallen mit unterschiedlichen Orientierungen erkannten Wissenschaftler Folgendes:
- Die Dispersion des Elektronenstrahls durch das metallische Glas war vergleichbar mit dem Phänomen von Interferenz und Beugung der Lichtstrahlen.
- Die Reflexion von Elektronen auf das Auswirkungen beschrieben die Flugbahn, die theoretisch nach der Broglie -Elektronenwellenentheorie beschreiben sollte.
Kurz gesagt haben Davisson und Germer-Experiment experimentell die Doppelwellen-Partikel-Natur von Elektronen bewiesen.
Kann Ihnen dienen: Polarer kovalenter Link: Merkmale und BeispieleEinschränkungen
Broglies Atommodell sagt nicht die genaue Position des Elektrons auf der Umlaufbahn voraus, in der es sich bewegt.
In diesem Modell werden Elektronen als Wellen wahrgenommen, die ohne einen bestimmten Ort im gesamten Orbit mobilisiert werden, wodurch das Konzept des elektronischen Orbitals eingeführt wird.

Darüber hinaus berücksichtigt das Atommodell von Broglie, analog zum Schrödinger -Modell, die Drehung der Elektronen auf derselben Achse nicht (drehen).
Durch das Ignorieren des intrinsischen Winkelimpulses von Elektronen werden die räumlichen Variationen dieser subatomaren Partikel beiseite gelassen.
In der gleichen Reihenfolge der Ideen berücksichtigt dieses Modell auch nicht die Änderungen des Verhaltens schneller Elektronen infolge der relativistischen Effekte.
Artikel von Interesse
Schrödinger Atommodell.
Chadwick Atomic Model.
Heisenberg Atomic Model.
Perrin Atommodell.
Thomson Atomic Model.
Dalton Atomic Model.
Dirac Jordan Atomic Model.
Democritus Atomic Model.
Leucipo -Atommodell.
BOHR -Atommodell.
Aktuelles Atommodell.
Verweise
- Bohrs Quantentheorie und de Broglie Wellen (s).F.). Erholt von: NE.Phys.Kyushu-u.AC.J
- Louis de Broglie - Biografisch (1929). © The Nobel Foundation. Erholt von: nobelprize.Org
- Louis-Victor de Broglie (s).F.). Abgerufen von: Chemed.Chem.Purdue.Edu
- Lovett, b. (1998). Louis de Broglie. Encyclopædia Britannica, Inc. Erholt von: Britannica.com
- De Broglie Atomic Model. Nationale Universität für Fernunterricht. Spanien. Erholt von: ocw.Innova.Uned.Ist
- Louis de Broglie.F.). Erholt von: Hiru.EUS
- Von Pamel oder., Und Marchisio, s. (S.F.). Quantenmechanik. Nationale Universität von Rosario. Erholt von: fceia.a r.Edu.ar

