Rutherford History Atomic Model, Experimente, Postulate
- 1582
- 415
- Joy Hort
Er Rutherford Atomic Model Es ist die Beschreibung des Atoms des britischen Physikers Ernest Rutherford (1871-1937), als er 1911 den Atomkern dank der berühmten Dispersionsexperimente entdeckte, die benannt sind.
Die Idee des Atoms ("unteilbar”In Griechisch) als die kleinste Komponente der Materie war es eine im alte Griechenland geborene intellektuelle Schöpfung, ungefähr 300 bis.C. Wie so viele andere griechische Konzepte wird das Konzept des Atoms auf der Grundlage von Logik und Argumentation entwickelt, aber nicht auf Experimenten.
 Rutherford Atomic Model
Rutherford Atomic Model Die bemerkenswertesten atomistischen Philosophen waren Demokrit von Abdera (460 - 360 v. Chr.), Epicurus von Samos (341 - 270 AC) und Tito Lucrecio (98 - 54 AC). Die Griechen konzipierten vier verschiedene Arten von Atomen, die den vier Elementen entsprachen, die nach ihnen die Angelegenheit bildeten: Luft, Wasser, Erde und Feuer.
Anschließend würde Aristoteles ein fünftes Element hinzufügen: den Äther, der die Sterne bildete, da die anderen vier Elemente rein terrestrisch waren.
Die Eroberungen von Alexander dem Großen, von denen Aristoteles ein Lehrer war, erweiterte seine Überzeugungen für die Antike von Spanien nach Indien und somit jahrhundertelang die Idee von Atom Er schuf seinen eigenen Platz in der Welt der Wissenschaft.
[TOC]
Das Atom hört auf, unteilbar zu sein
Die Ideen der griechischen Philosophen über die Struktur des Themas wurden Hunderte von Jahren als bestimmt gehalten, bis ein englischer Chemiker und Lehrer namens John Dalton (1776-1844) die Ergebnisse seiner Experimente 1808 veröffentlichte.
Dalton stimmte zu, dass die Elemente aus extrem kleinen Partikeln bestehen, die Atome genannt werden. Aber es ging weiter, indem festgestellt wurde, dass alle Atome desselben Elements gleich sind, sie sind gleich groß, die gleiche Masse und dieselben chemischen Eigenschaften, was sie während einer chemischen Reaktion unverändert bleibt.
Dies ist das erste Atommodell mit einer wissenschaftlichen Stiftung. Wie die Griechen betrachtete Dalton das Atom weiterhin als unteilbar und fehlte daher eine Struktur. Daltons Genie führte ihn jedoch dazu, eines der großen Prinzipien der Erhaltung der Physik zu beobachten:
- In chemischen Reaktionen, Atome werden weder geschaffen noch zerstört, Sie ändern nur ihre Verteilung.
Und stellte die Art und Weise fest, wie chemische Verbindungen durch „Verbundatome“ (Moleküle) gebildet wurden:
- Wenn zwei oder mehr Atome verschiedener Elemente zu derselben Verbindung kombiniert werden, tun sie dies immer in Massenproportionen definiert und konstant.
Das 19. Jahrhundert war das große Jahrhundert von Strom und Magnetismus. Einige Jahre nach Daltons Veröffentlichungen säten die Ergebnisse einiger Experimente den Wissenschaftlern an der Unteilbarkeit des Atoms Zweifel.
Kann Ihnen dienen: Was ist die kapazitive Reaktanz und wie man sie berechnet??Crookes Tube
Das Crookes Tube war ein Gerät, das vom britischen Chemiker und Meteorologen William Crookes (1832-1919) entworfen wurde. Das Experiment, das 1875 von Crookes durchgeführt wurde Kathode und ein anderer rief Anode.
Durch die Herstellung einer Potentialdifferenz zwischen beiden Elektroden leuchtete Gas mit einer Farbe, die für das verwendete Gas charakteristisch war. Diese Tatsache deutete darauf hin, dass es eine bestimmte Organisation innerhalb des Atoms gab und dass sie daher nicht unteilbar war.
Darüber hinaus erzeugte diese Strahlung eine schwache Fluoreszenz in der Glasrohrwand vor der Kathode und schnitt den Schatten einer Kreuzung im Röhrchen, die sich im Röhrchen befindet.
Es war eine mysteriöse Strahlung, die als "Kathodenstrahlen" bekannt war, die in einer geraden Linie zur Anode fuhr und die hoch energisch war, mechanische Effekte erzeugen und zu einer positiv beladenen Platte oder auch von Magneten abweichen konnte.
Die Entdeckung des Elektrons
Strahlung innerhalb des Crookes -Rohrs konnte nicht behandelt werden, da sie eine negative Belastung hatte. Joseph John Thomson (1856 - 1940) fand die Antwort im Jahr 1887, als er die Beziehung zwischen Last und Masse dieser Strahlung fand, und stellte fest, dass es immer dasselbe war: 1,76 x 10elf C/kg., Unabhängig von dem im Röhrchen gesperrten Gas oder dem Material, das zur Herstellung der Kathode verwendet wird.
Thomson nannte diese Partikel Korpuskeln. Durch die Messung seiner Masse in Bezug auf seine elektrische Ladung kam es zu dem Schluss, dass jeder Korpuskel viel kleiner als ein Atom war. Daher schlug er vor, dass sie Teil von ihnen sein sollten und so die Entdeckung des Elektron.
Der britische Wissenschaftler war der erste, der ein Grafikmodell des Atoms durch die Zeichnung einer Kugel mit eingefügten Punkten skizzierte, die durch seine Form die Bezeichnung von "Buddin of Ciruela" erhielten. Diese Entdeckung brachte jedoch andere Fragen:
- Wenn die Angelegenheit neutral ist und das Elektron eine negative Belastung hat: In welchem Teil des Atoms ist die positive Belastung, die die Elektronen neutralisiert?
- Wenn die Elektronenmasse niedriger ist als die des Atoms, woraus der Rest des Atoms besteht??
- Warum wurden die Partikel immer Elektronen und niemals von einem anderen Typ erhalten??
Rutherford Dispersionsexperimente: Der Atomkern und Proton
Bis 1898 hatte Rutherford zwei Arten von Strahlung aus Uran identifiziert, die er nannte Alpha Und Beta.
Die natürliche Radioaktivität wurde bereits 1896 von Marie Curie entdeckt. Alpha -Partikel haben eine positive Belastung und sind einfach Heliumkerne, aber zu diesem Zeitpunkt war das Konzept des Kerns noch nicht bekannt. Rutherford wollte es entdecken.
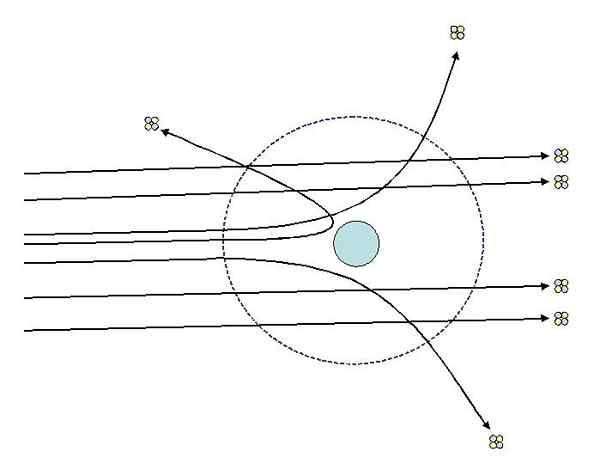
Kann Ihnen dienen: thermodynamisches System: Eigenschaften, Typen, BeispieleEines der Experimente, die Rutherford 1911 an der Manchester University mithilfe von Hans Geiger gemacht hat, bestand darin, ein feines Goldblatt mit Partikeln zu bombardieren Alpha, deren Last ist positiv. Rund um das Goldblatt platzierte einen fluoreszierenden Bildschirm, mit dem sie die Auswirkungen des Bombenangriffs visualisieren konnten.
Beobachtungen
Rutherford und seine Assistenten untersuchten die Auswirkungen auf den fluoreszierenden Bildschirm und beobachteten:
- Ein hoher Prozentsatz an Alpha -Partikeln überquerte das Blatt ohne merkliche Abweichung.
- Einige wichen in ziemlich ausgeprägten Winkeln ab
- Und sehr wenig rückwärts abprallte
 Rutherford Dispersionsexperimente. Quelle: [CC BY-SA 3.0 (http: // creativecommons.Org/lizenzen/by-sa/3.0/]].
Rutherford Dispersionsexperimente. Quelle: [CC BY-SA 3.0 (http: // creativecommons.Org/lizenzen/by-sa/3.0/]]. Die Beobachtungen 2 und 3 überraschten die Ermittler und führten sie an, dass die für die Strahlen verantwortliche Person eine positive Ladung haben sollte und dass diese verantwortliche Person aufgrund der Beobachtungsnummer 1 eine viel kleinere Größe hatte als die der Alpha -Partikel.
Rutherford selbst sagte in dieser Hinsicht, dass es "... als hätten Sie ein 15 -Zoll -Marineprojektil gegen ein Blatt Papier und das Projektil zurückgegriffen und Sie getroffen", und Sie schlugen Sie. ". Dies könnte definitiv vom Thompson -Modell erklärt werden.
Rutherford analysierte seine Ergebnisse aus klassischer Sicht und hatte die Existenz des Atomkerns entdeckt, wo die positive Belastung des Atoms, die diese Neutralität ergab, konzentriert war.
Rutherford fuhr mit seinen Dispersionsexperimenten fort. Bis 1918 waren das neue Ziel der Alpha -Partikel die Atome des gasförmigen Stickstoffs.
Auf diese Weise erkannte es Wasserstoffkerne und wusste sofort, dass die einzige Stelle, aus der diese Kerne aus Stickstoff selbst stammen, selbst stammen konnte. Wie war es möglich, dass Wasserstoffkerne Teil des Stickstoffs waren?
Rutherford schlug dann vor, dass der Wasserstoffkern, ein Element, dem bereits die Atomzahl 1 zugewiesen wurde, ein grundlegendes Teilchen sein sollte. ich rufe Sie an Proton, Griechisches Wort zu bestimmen Erste. So sind die Entdeckungen des Atomkerns und des Protons auf dieses brillante Neozyre zurückzuführen.
Postuliert Rutherfords Atommodell
Das neue Modell war ganz anders als Thompsons. Dies waren seine Postulate:
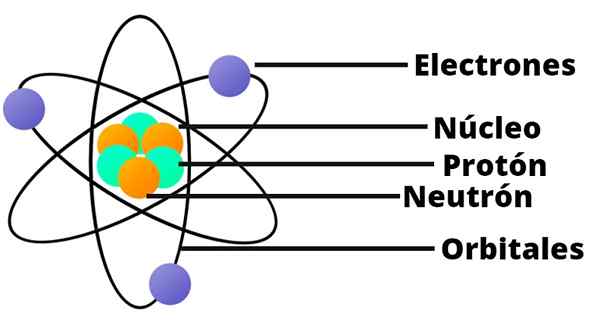
- Das Atom enthält einen positiv beladenen Kern, der trotz sehr kleiner, fast die gesamte Masse des Atoms enthält.
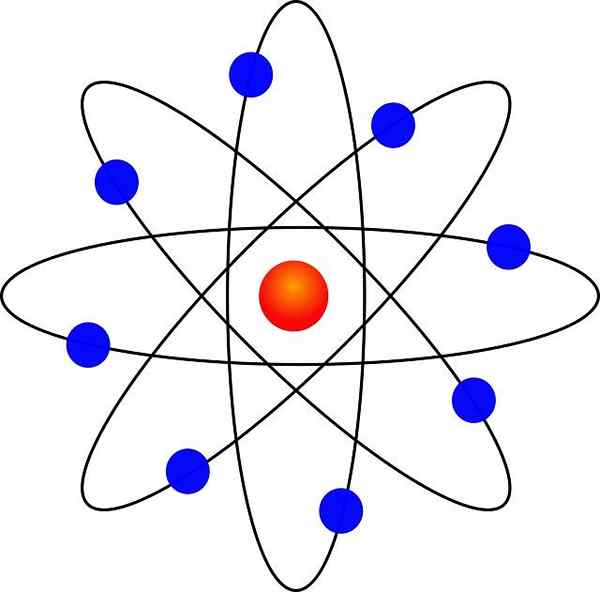
- Elektronen umdrehen den Atomkern in großem Abstand und in kreisförmigen oder elliptischen Umlaufbahnen.
- Die Nettobelastung des Atom.
Rutherfords Berechnungen wiesen auf einen sphärischen Kern und ein Radio von nur 10 hin-fünfzehn M, der Wert des Atomradius von etwa 100 ist.000 -mal höher, da die Kerne vergleichsweise sehr weit voneinander entfernt sind: aus der Größenordnung von 10-10 M.
 Der junge Ernest Rutherford. Quelle: Unbekannt, veröffentlicht 1939 in Rutherford: Das Leben und die Buchstaben der RT sind. Hon. Lord Rutherford, oder. M [CC von 4.0 (https: // creativecommons.Org/lizenzen/bis/4.0)]]
Der junge Ernest Rutherford. Quelle: Unbekannt, veröffentlicht 1939 in Rutherford: Das Leben und die Buchstaben der RT sind. Hon. Lord Rutherford, oder. M [CC von 4.0 (https: // creativecommons.Org/lizenzen/bis/4.0)]] Dies erklärt, warum die meisten Alpha -Partikel das Blatt ohne Unannehmlichkeiten überquerten oder kaum eine sehr kleine Ablenkung erlebten.
Rutherfords Atom bei alltäglichen Objekten würde aus einem Kern der Größe eines Baseballs bestehen, während der Atomradius etwa 8 km betragen würde. Daher kann das Atom fast alles als leerer Raum betrachtet werden.
Dank seiner Ähnlichkeit mit einem Miniatur -Sonnensystem wurde es als "Planetary Model of the Atom" bezeichnet. Die elektrostatische Anziehungskraft zwischen Kern und Elektronen wäre analog zur Gravitationsanziehung zwischen der Sonne und den Planeten.
Einschränkungen
Es gab jedoch bestimmte Meinungsverschiedenheiten in einigen beobachteten Fakten:
- Wenn die Vorstellung, dass der Elektronenumlauf um den Kern akzeptiert wird. Dies ist glücklicherweise nicht das, was wirklich passiert.
- Darüber hinaus emittiert das Atom bei bestimmten Gelegenheiten bestimmte Frequenzen elektromagnetischer Strahlung, wenn Übergänge zwischen einem Zustand größerer Energie zu einer mit weniger Energie und nur diesen Frequenzen vorhanden sind, nicht andere. Wie man die Tatsache erklärt, dass Energie quantisiert wird?
Trotz dieser Einschränkungen und heute, dass es heute viel ausgefeiltere Modelle gibt, und nach den beobachteten Tatsachen ist Rutherfords Atommodell immer noch nützlich, damit der Schüler einen ersten erfolgreichen Ansatz des Atoms und seiner Bestandteile hat.
In diesem Modell des Atoms erscheint Neutron nicht, ein weiterer Bestandteil des Kerns, der erst 1932 entdeckt wurde.
Eine kurze Zeit nachdem Rutherford sein planetarisches Modell vorgeschlagen hatte. 1913 modifiziert der dänische Physiker Niels Bohr ihn, um zu erklären, warum das Atom nicht zerstört wird und wir immer noch hier sind, um diese Geschichte zu erzählen.
Artikel von Interesse
Schrödinger Atommodell.
Broglie Atomic Model.
Chadwick Atomic Model.
Heisenberg Atomic Model.
Perrin Atommodell.
Thomson Atomic Model.
Dirac Jordan Atomic Model.
Democritus Atomic Model.
BOHR -Atommodell.
Dalton Atomic Model.
Verweise
- Rex, a. 2011. Grundlagen der Physik. Pearson. 618-621.
- Zapata, f. 2007. Klassennotizen für den Stuhl für Radiobiologie und Radiological Protection. Öffentliche Gesundheitsschule der Central University of Venezuela.
- « Ionenverbindungseigenschaften, wie Formen und Beispiele
- Was ist ein Berichterstatter und wie man a macht? »

