Thomson Atomic -Modelleigenschaften, Postulate, subatomare Partikel
- 5045
- 1228
- Frederike Birkemeyer
Er Thomson Atomic Model Es wurde von dem englischen physischen Jerer J erstellt. J. J. Thomson, der das Elektron entdeckte. Aufgrund dieser Entdeckung und ihrer Arbeiten über die elektrische Leitung bei Gasen wurde sie 1906 mit dem Nobelpreis für Physik vergeben.
Aus seiner Arbeit mit den Kathodenstrahlen wurde herausgefunden, dass das Atom keine unteilbare Einheit war, wie Dalton im vorhergehenden Modell postuliert hatte, sondern dass es eine gut definierte interne Struktur enthielt.

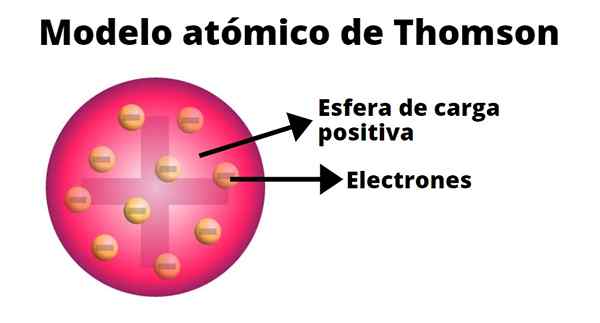
Thomson entwickelte ein Atommodell, das auf den Ergebnissen seiner Experimente mit Kathodenstrahlen basiert. In ihm bestätigte er, dass das elektrisch neutrale Atom von positiven und negativen Ladungen gleicher Größe gebildet wurde.
[TOC]
Wie hieß Thomsons Atommodell und warum?
Laut Thomson wurde die positive Belastung im gesamten Atom verteilt und die negativen Ladungen wurden darin eingebettet, als wären sie die Rosinen eines Pudding. Aus diesem Vergleich entstand der Begriff "Rosinenpudding", da das Modell informell bekannt war.
 Joseph John Thomson
Joseph John Thomson Während Thomsons Idee derzeit ziemlich primitiv ist, stellte er für seine Zeit einen neuartigen Beitrag dar. Während der kurz.
Schließlich entstanden 1910 neue Beweise über die Atomstruktur und Thomsons Modell blieb schnell beiseite. Dies geschah, sobald Rutherford die Ergebnisse seiner Dispersionsexperimente veröffentlichte, die die Existenz des Atomkerns zeigten.
Thomsons Modell war jedoch das erste, das die Existenz von subatomaren Partikeln postulierte, und ihre Ergebnisse waren die Frucht eines feinen und strengen Experimentierens. Auf diese Weise etablierte er den Präzedenzfall für alle folgenden Entdeckungen.
Eigenschaften und Postulate des Thomson -Modells
Thomson kam zu seinem Atommodell an, basierend auf mehreren Beobachtungen. Das erste war, dass die von Roentgen neu entdeckten X -Strahlen Luftmoleküle ionisieren konnten. Bis dahin war die einzige Möglichkeit, die Ionen chemisch in eine Lösung zu trennen.
Aber der englische Physiker ionisieren sogar monoatomische Gase wie Helium durch X -Strahlen. Dies führte ihn zu der Annahme, dass die Last im Atom getrennt werden konnte und dass sie daher nicht unteilbar war.Er beobachtete auch, dass Kathodenstrahlen durch elektrische und magnetische Felder umgeleitet werden konnten.
 J.J. Thomson, Entdecker des Elektrons. Quelle: LAFER.
J.J. Thomson, Entdecker des Elektrons. Quelle: LAFER. Dann entwickelte Thomson ein Modell, das korrekt die Tatsache erklärte, dass das Atom elektrisch neutral ist und dass die Kathodenstrahlen aus Partikeln mit negativer Belastung bestehen.
Mit Vermessung experimenteller Beweise charakterisierte Thomson das Atom wie folgt:
-Das Atom ist eine elektrisch neutrale feste Kugel mit einem ungefähren Radius von 10-10 M.
-Die positive Belastung wird von der Kugel mehr oder weniger gleichmäßig verteilt.
-Das Atom enthält negativ belastet "Korpuskeln", die ihre Neutralität gewährleisten.
-Diese Korpuskeln sind für alle Materie gleich.
-Wenn das Atom im Gleichgewicht ist, gibt es da N Korpuskeln, die regelmäßig in Ringen innerhalb der positiven Belastungskugel angeordnet sind.
-Die Masse des Atoms ist einheitlich verteilt.
Kathodenstrahlen
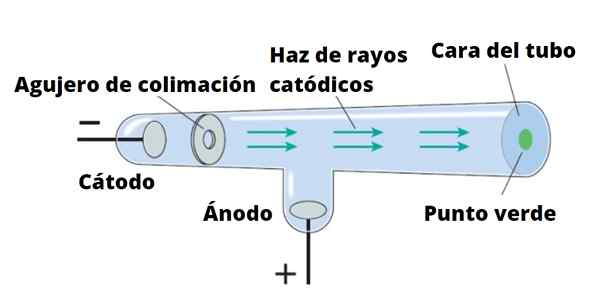
 Der Elektronenstrahl wird von der Kathode zur Anode gerichtet.
Der Elektronenstrahl wird von der Kathode zur Anode gerichtet. Thomson führte seine Experimente mit Kathodenstrahlen durch, die 1859 entdeckt wurden. Kathodenstrahlen sind negativ geladene Partikel. Um sie zu produzieren, werden Vakuumkristallrohre verwendet, in denen zwei Elektroden platziert werden, genannt Kathode Und Anode.
Kann Ihnen dienen: Magnetismus: Magnetische Eigenschaften von Materialien, verwendetDann wird ein elektrischer Strom bestanden, der die Kathode erhitzt, die somit unsichtbare Strahlung abgibt, die direkt an die gegenüberliegende Elektrode gerichtet ist.
Um Strahlung zu erkennen, die nichts anderes als Kathodenstrahlen ist, ist die Rohrwand mit einem fluoreszierenden Material bedeckt. Wenn Strahlung dorthin kommt, gibt die Rohrwand eine intensive Leuchtkraft ab.
Wenn ein festes Objekt auf dem Weg der Kathodenstrahlen eingebaut wird, wirft es einen Schatten auf die Rohrwand. Dies zeigt an, dass die Strahlen in einer geraden Linie reisen und dass sie sie leicht blockieren können.
Die Art der Kathodenstrahlen wurde weithin diskutiert, da ihre Natur unbekannt war. Einige dachten, sie seien elektromagnetische Wellen, während andere argumentierten, dass es sich um Partikel handelte.
Subatomare Teilchen von Thomson Atomic Model
Thomsons Atommodell ist, wie wir sagten. Thomsons Korpuskeln sind nichts anderes als Elektronen, die grundlegenden Partikel des negativ belasteten Atoms.
Wir wissen derzeit, dass die beiden anderen grundlegenden Partikel das Proton sind, positiv beladen und das Neutron ohne Last.
Diese wurden jedoch nicht entdeckt, als Thomson sein Modell ausarbeitete. Die positive Ladung des Atom.
Aus diesem Grund hatte sein Modell eine flüchtige Existenz, da im Laufe einiger Jahre Rutherfords Dispersionsexperimente den Weg für die Entdeckung des Protons eröffneten. Und was das Neutron betrifft, schlug Rutherford selbst einige Jahre vor seiner Entdeckung vor seiner Existenz vor.
Die Crookes -Röhre
Sir William Crookes (1832-1919) entwarf die Röhre, die seinen Namen um 1870 trägt, mit der Absicht, die Natur von Kathodenstrahlen sorgfältig zu untersuchen. Er fügte elektrische Felder und Magnetfelder hinzu und beobachtete, dass die Strahlen von diesen abgeleitet wurden.
 Kathodenstrahlrohrschema. Quelle: Ritter, r.
Kathodenstrahlrohrschema. Quelle: Ritter, r. Auf diese Weise fanden Crookes und andere Forscher, einschließlich Thomson, Folgendes fest:
- In der Kathodenstrahlrohr wurde ein elektrischer Strom erzeugt
- Die Strahlen wurden durch das Vorhandensein von Magnetfeldern auf die gleiche Weise wie die negativ geladenen Partikel abgewichen.
- Jedes Metall, das zur Herstellung der Kathode verwendet wurde, war gleichermaßen gut, um Kathodenstrahlen zu produzieren, und ihr Verhalten war unabhängig vom Material.
Diese Beobachtungen haben die Diskussion über den Ursprung der Kathodenstrahlen angeheizt. Diejenigen, die argumentierten, dass sie Wellen waren. Darüber hinaus erklärte diese Hypothese sehr gut den Schatten, dass ein interponiertes festes Objekt an die Röhrungswand geworfen wurde, und unter bestimmten Umständen war bekannt, dass die Wellen Fluoreszenz verursachen könnten.
Stattdessen wurde nicht verstanden, wie möglich war, dass die Magnetfelder die Kathodenstrahlen ablenkten. Dies hatte nur eine Erklärung, wenn diese Strahlen als Partikel angesehen wurden, eine Hypothese, die Thomson teilte.
Partikel, die in gleichmäßige elektrische und magnetische Felder beladen sind
Ein Partikel mit Q -Last, erfährt eine Glaubenskraft in der Mitte eines gleichmäßigen elektrischen Feldes und in der Größe:
Kann Ihnen dienen: Wellenkundige Lichttheorie: Erklärung, Anwendungen, BeispieleGlaube = QE
Wenn ein beladenes Partikel senkrecht ein gleichmäßiges elektrisches Feld überschreitet, wie das, das zwischen zwei Platten mit entgegengesetzten Lasten auftritt, erfährt es eine Abweichung und damit eine Beschleunigung:
qe = ma
a = qe/m
Wenn sich das beladene Partikel mit der Größe V -Geschwindigkeit in der Mitte eines gleichmäßigen Magnetfelds B der Größe B bewegt, hat die Magnetkraft FM, die die folgende Intensität erfährt, die folgende Intensität:
Fm = qvb
Solange die Geschwindigkeit und die Magnetfeldvektoren senkrecht sind. Wenn ein beladenes Teilchen senkrecht in einem homogenen Magnetfeld betrifft, erfährt es auch eine Abweichung und seine Bewegung ist einheitlich kreisförmig.
Zentripetalbeschleunigung zuC In diesem Fall ist es:
Qvb = maC
Die Zentripetalbeschleunigung hängt wiederum mit der Geschwindigkeit von Partikeln V und dem Radius R der kreisförmigen Flugbahn zusammen:
ZuC = v2/R
Deshalb:
Qvb = mv2/R
Der Radius der kreisförmigen Flugbahn könnte wie folgt berechnet werden:
R = mv/qb
Später werden diese Gleichungen verwendet, um die Art und Weise wiederherzustellen.
Thomsons Experiment
Thomson passierte einen Strahl von Kathodenstrahlen, einen Elektronenstrahl, obwohl er immer noch nicht wusste, durch gleichmäßige elektrische Felder. Diese Felder werden zwischen zwei leitenden Platten erzeugt, die in geringem Abstand beladen und getrennt sind.
Kathodenstrahlen gingen auch durch ein gleichmäßiges Magnetfeld und beobachteten den Effekt, den dies auf den Strahl hatte. Sowohl in einem Feld als auch auf dem anderen gab es eine Ablenkung in den Strahlen, die Thomson zu Recht denkt, dass der Strahl aus geladenen Partikeln bestand.
Um zu überprüfen, führte Thomson mehrere Strategien mit den Kathodenstrahlen durch:
- Variieren Sie die elektrischen und magnetischen Felder, bis die Kräfte aufgehoben wurden. Auf diese Weise gingen die Kathodenstrahlen durch, ohne die Ablenkung zu experimentieren. Übereinstimmende elektrische und magnetische Kräfte gelang es Thomson, die Geschwindigkeit der Strahlpartikel zu bestimmen.
- Annulled die Intensität des elektrischen Feldes, auf diese Weise folgten die Partikel einer kreisförmigen Flugbahn in der Mitte des Magnetfeldes.
- Kombinierte die Ergebnisse der Schritte 1 und 2, um das Lastverhältnis der "Korpuskeln" zu bestimmen.
Das Elektronenfrachtverhältnis
Thomson stellte fest, dass das Frachtverhältnis der Partikel, die den Kathodenstrahlenstrahlen bildeten, den folgenden Wert aufweist:
Q/m = 1.758820 x 10 11 c.kg-1.
Wobei Q die Last des "Korpuskels" darstellt, der tatsächlich das Elektron ist und M Es ist die Masse derselben. Thomson folgte dem im vorherigen Abschnitt beschriebenen Verfahren, den wir hier Schritt für Schritt mit den von ihm verwendeten Gleichungen neu erstellen,.
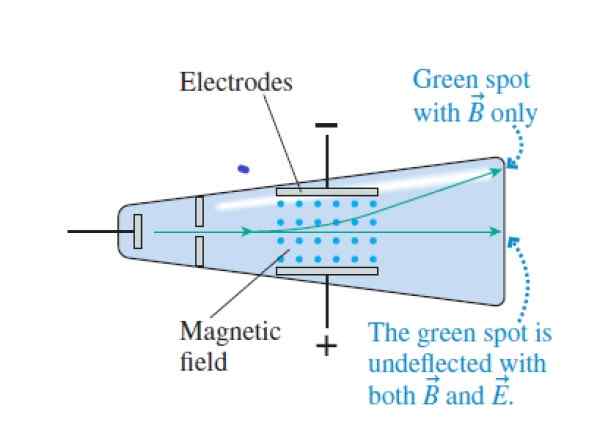 Wenn die Kathodenstrahlen das Kreuz und die Magnetfelder überqueren, gehen sie ohne Ablenkung vorbei. Wenn das elektrische Feld aufgehoben wird, beeinflussen sie die Oberseite des Rohrs (das Magnetfeld ist mit den blauen Punkten zwischen den Elektroden angezeigt). Quelle: Ritter, r.
Wenn die Kathodenstrahlen das Kreuz und die Magnetfelder überqueren, gehen sie ohne Ablenkung vorbei. Wenn das elektrische Feld aufgehoben wird, beeinflussen sie die Oberseite des Rohrs (das Magnetfeld ist mit den blauen Punkten zwischen den Elektroden angezeigt). Quelle: Ritter, r. Schritt 1
Passen Sie die elektrische Kraft und die Magnetkraft an und führen Sie den Strahl durch die senkrechten elektrischen und magnetischen Felder:
Qvb = qe
Schritt 2
Bestimmen Sie die Geschwindigkeit, die die Strahlpartikel erfasst haben, wenn sie direkt ohne Ablenkung passieren:
V = e/b
Schritt 3
Stornieren Sie das elektrische Feld und lassen Sie nur das Magnetfeld (jetzt gibt es ablenkt):
R = mv/qb
Mit V = E/B -Ergebnissen:
R = me/qb2
Der Radius der Umlaufbahn kann daher gemessen werden:
Q/m = v/rb
Ach ja:
Q/m = e/rb2
Nächste Schritte
Das nächste, was Thomson tat, war, den Quotienten Q/M unter Verwendung von Kathoden aus verschiedenen Materialien zu messen. Wie oben erwähnt, emittierte alle Metalle Kathodenstrahlen mit identischen Eigenschaften.
Kann Ihnen dienen: Induktive ReaktanzDann verglich Thomson seine Werte mit denen des Q/M -Verhältnisses des Wasserstoffionen, das durch Elektrolyse erhalten wurde und deren Wert ungefähr 1 x 10 beträgt8 C/kg. Der Elektronlast-MASA-Quotient ist ungefähr 1750-mal höher als Wasserstoffionen.
Daher hatten die Kathodenstrahlen eine viel größere Belastung oder vielleicht eine Masse, die viel kleiner als das Wasserstoffionen ist. Wasserstoffionen ist einfach ein Proton, dessen Existenz die Zeit nach Rutherfords Dispersionsexperimenten war.
Heute ist bekannt, dass das Proton fast 1800 Mal massiver ist als das Elektron und mit Last von gleichen Größe und Vorzeichen im Gegensatz zu dem des Elektrons.
Ein weiteres wichtiges Detail ist, dass bei Thomsons Experimenten die elektrische Ladung des Elektrons weder bestimmt wurde noch der Wert seiner Masse getrennt. Diese Werte wurden durch Millikans Experimente bestimmt, die 1906 begannen.
Thomson und Dalton modellieren Unterschiede
Der grundlegende Unterschied dieser beiden Modelle besteht darin, dass Dalton dachte, dass das Atom eine Sphäre ist. Im Gegensatz zu Thomson schlug er nicht die Existenz positiver oder negativer Ladungen vor. Für Dalton war ein Atom so:
 Dalton Atom
Dalton Atom Wie wir bereits gesehen haben, dachte Thomson, dass das Atom teilbar war und deren Struktur durch eine positive Sphäre und Elektronen ums Leben gekommen ist.
Modellfehler und Einschränkungen
Zu dieser Zeit gelang es Thomsons Atommodell, das chemische Verhalten von Substanzen sehr gut zu erklären. Er erklärte auch zu Recht die Phänomene, die in der Kathodenstrahlrohr aufgetreten sind.
Tatsächlich hat Thomson jedoch nicht einmal seine "Elektronen" -Partikel angerufen, obwohl der Begriff bereits zuvor von George Johnstone Stoney geprägt worden war. Thomson nannte sie einfach "Korpuskeln".
Obwohl Thomson all das Wissen nutzte, das er im Moment hatte, gibt es in seinem Modell mehrere wichtige Einschränkungen, die sehr bald offensichtlich waren:
-Die positive Belastung wird im gesamten Atom nicht verteilt. Rutherfords Dispersionsexperimente zeigten, dass die positive Belastung des Atoms notwendigerweise auf eine kleine Region beschränkt ist, die später als Atomkern bekannt wurde.
-Elektronen haben eine spezifische Verteilung innerhalb jedes Atoms. Die Elektronen sind nicht gleichmäßig verteilt, wie die Rosinen des berühmten Buddin, sondern haben eine Disposition in Orbitalen, die die nachfolgenden Modelle gezeigt haben.
Genau die Disposition von Elektronen innerhalb des Atom. Dies war eine wichtige Einschränkung des Thomson -Modells, die nicht erklären konnte, wie es möglich war, die Elemente auf diese Weise zu ordnen.
-Der Atomkern ist derjenige, der den größten Teil des Teigs enthält. Thomsons Modell postulierte, dass die Masse des Atoms einheitlich im Inneren verteilt war. Aber heute wissen wir, dass die Masse des Atoms praktisch in den Protonen und Neutronen des Kerns konzentriert ist.
Es ist auch wichtig hervorzuheben, dass dieses Atommodell nicht zulassen, dass die Art der Bewegung, die Elektronen innerhalb des Atoms hatten.
Artikel von Interesse
Schrödinger Atommodell.
Broglie Atomic Model.
Chadwick Atomic Model.
Heisenberg Atomic Model.
Perrin Atommodell.
Dalton Atomic Model.
Dirac Jordan Atomic Model.
Democritus Atomic Model.
Leucipo -Atommodell.
BOHR -Atommodell.
Sommerfeld Atommodell.
Aktuelles Atommodell.
Verweise
- Andriessen, m. 2001. HSC -Kurs. Physik 2. Jacaranda HSC Science.
- Arfken, g. 1984. Universitätsphysik. Akademische Presse.
- Ritter, r. 2017. Physik für Wissenschaftler und Ingenieurwesen: Ein Strategieansatz. Pearson.
- Rex, a. 2011. Grundlagen der Physik. Pearson.
- Wikipedia. Thomson Atomic Model. Erholt von: Es ist.Wikipedia.Org.
- « Allgemeine Formel quadratische Gleichungen, Beispiele, Übungen
- Aomic -Modell der Merkmale und Postulate von Dirac Jordan »

