Korpuskulärmodell der Materie
- 1384
- 242
- Nick Laurén
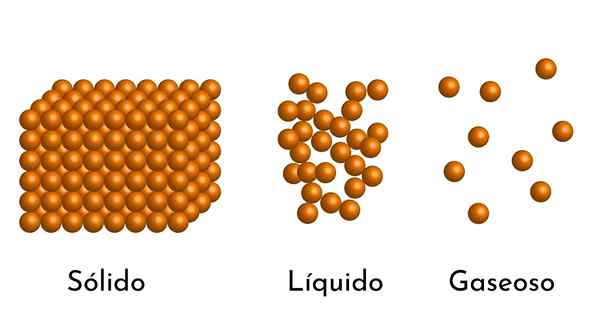
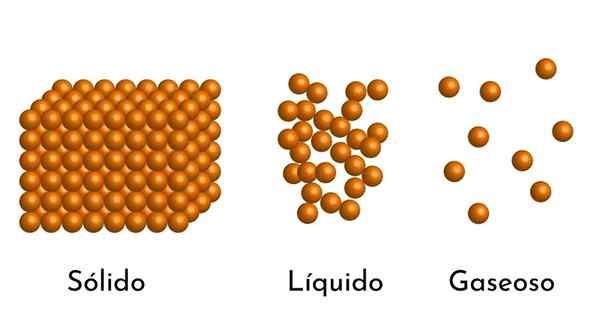 Die bekanntesten Zustände der Materie haben ihre Erklärung im korpuskulären Modell der Materie
Die bekanntesten Zustände der Materie haben ihre Erklärung im korpuskulären Modell der Materie Was ist das korpuskuläre Modell der Materie??
Er Korpuskulärmodell der Materie Es ist ein Modell der mikroskopischen Struktur der Materie, das versucht, die Eigenschaften und das Verhalten in jedem Aggregationszustand zu erklären.
Das grundlegende Postulat des Modells ist, dass Materie aus kleinen Partikeln besteht, die Atome, Ionen oder Moleküle sein können, immer in kontinuierlicher Bewegung.
In diesem Modell gelten die Gesetze der klassischen Mechanik für Partikel, obwohl sie nach der großen Anzahl nicht einzeln, sondern durch eine statistische Behandlung untersucht werden. Auf diese Weise werden die Durchschnittswerte der makroskopischen Größen von interessierten Größen wie Druck, Temperatur und Volumen erhalten.
Das korpuskuläre Modell erklärt auch Eigenschaften wie Viskosität, Härte, Flexibilität und Materialdichte sowie thermische Dilatation, unter anderem Phänomene.
Ursprünge des Korpuskulärmodells der Materie
Die Ideen über die korpuskuläre Natur der Materie datieren mindestens das 5. Jahrhundert.C. Im alten Griechenland Leucipo (450 a. C. - 370 a. C.) und Demokrit (460 bis 370 bis C), der den Schüler davon über die Organisation von Materie auf mikroskopischer Ebene spekuliert hatte.
Diese Philosophen schlugen vor, dass die Materie aus winzigen unteilbaren Partikeln besteht, die ernannt wurden Atome, Ein Wort der griechischen Wurzel, das präzise "unteilbar" bedeutet.
Die Theorie wurde von Aristoteles ausgeschlossen, dem einflussreichsten Weisen seiner Zeit. Erst im 17. Jahrhundert begann die korpuskuläre Theorie wieder Relevanz, und im 19. Jahrhundert begannen die Geheimnisse der Materie schließlich zu enthüllen.
1803 schlug der englische Chemiker John Dalton (1766-1844) erneut vor, dass die Angelegenheit durch Korpuskeln gebildet wurde, die Atome genannt werden, die in bestimmten Anteilen kombinierten, um die Moleküle einer Substanz zu bilden.
Daltons Atome waren unteilbar, aber bald wurde eine solide theoretische Struktur entwickelt, insbesondere dank James C. Maxwell (1831-1979) und Ludwig Boltzmann (1844-1906). Dies etablierte die Grundlagen der statistischen Mechanik und die Physik des Festkörperstaates.
Es kann Ihnen dienen: Durchschnittsgeschwindigkeit: Formeln, wie es berechnet und gelöst wirdGrundlagen des Korpuskulärmodells der Materie
Die Haupt Postulate des Modells sind:
- Materie, unabhängig von ihrem Status der Aggregation, wird durch mikroskopische Partikel gebildet, die individuelle oder kombinierte Atome sein können, um Moleküle zu bilden.
- Die verschiedenen Substanzen unterscheiden sich voneinander, weil sie aus verschiedenen Partikeln bestehen.
- Nach dem Aggregationszustand gibt es leere Räume zwischen den Partikeln, größer in den Gasen und bei Festkörpern kleiner.
- Die Partikel, die die Angelegenheit ausmachen. Zu einer größeren Erregung, einer größeren kinetischen Energie, und wenn Wärme hinzugefügt wird, wird die Bewegung der Partikel erhöht.
- Auch in Flüssigkeiten und Feststoffen erleben die Partikel aufgrund intermolekularer Kräfte eine Anziehungskraft unterschiedlicher Intensität. In Gasen sind die Moleküle sehr getrennt und bewegen sich schnell, sodass diese Kräfte keine größere Inzidenz haben. Aber in Flüssigkeiten, deren Partikel mehr Zusammenhalt haben, sind diese Kräfte intensiver und bei Festkörpern noch größer.
Kinetische Gasentheorie
Das korpuskuläre Modell wurde zuerst auf Gase angewendet, da es der einfachste Zustand der Aggregation und Kohäsionskräfte zwischen den Molekülen ist minimal. Darüber hinaus waren die Eigenschaften der Gase durch die experimentellen Werke des englischen Chemikers Robert Boyle und des französischen Joseph Gay Lussac und Jacques Charles bekannt.
Das ideale Gasenmodell, das einfachste, betrachtet:
- Die Größe der Partikel ist viel kleiner als die Abstände zwischen ihnen und die Abmessungen des Behälters. Sie sind bestimmte Massen, das heißt, ohne Abmessungen und kein Volumen einnimmt.
- Die Partikel sind in dauerhafter Agitation und sind ihre Bewegung nur der Übersetzung.
- Gelegentlich kollidieren die Partikel elastisch, miteinander und mit den Wänden des Behälters. In völlig elastischen Schocks bleibt die kinetische Energie erhalten.
- Es gibt keine attraktiven Kräfte zwischen Molekülen. Die einzigen Wechselwirkungen sind auf Kollisionen zurückzuführen, die von Zeit zu Zeit und für eine sehr kurze Zeit auftreten. Von den anderen handelt jedes Molekül unabhängig von den anderen.
- Wenn es keine externen Kräfte gibt, die auf das Partikelsystem wirken.
Obwohl dies das einfachste Modell ist, erklärt das Verhalten von dichten Gas bei hohen Temperaturen und niedrigen Drücken. Wissenschaftler haben andere besser angepasste Modelle für das Verhalten realer Gase entwickelt, da sie dies bedenken:
- Die Moleküle haben eine messbare Größe.
- Intermolekulare Kräfte werden nicht abgesagt.
Ideale Gasgleichung
Dank der Postulate des idealen Gases entsteht ein Ausdruck, der die makroskopischen Größen des Drucks P, Volumen V und Temperatur t:
P ∙ v = nrt
Wobei n die Anzahl der Gasmolen und R ist die universelle Konstante der Gase, deren Wert in internationalen Systemeinheiten 8 beträgt.314 j/mol ∙ k.
Kinetische Energie und Temperatur
In einem idealen Gas manifestiert sich die gesamte innere Energie als kinetische Energie. Die durchschnittliche kinetische Energie der N -Moleküle eines idealen Gases ist direkt proportional zu ihrer Temperatur in Kelvin:
Korpuskulärmodell in Flüssigkeiten und Feststoffen
Tatsächlich finden Sie alle Materie in den drei einfachsten Zuständen: wie Gas, Flüssigkeit oder Feststoff, abhängig von Druck und Temperatur. Es gibt andere Aggregationszustände wie Plasma, aber nicht nahe an der Erdoberfläche.
Diese Zustände sind auf die Art und Weise zurückzuführen. Dies ist der Fall von Gasen, die das Phänomen der Diffusion Schneller. Dies erklärt, dass sich das Aroma durch die Aufdeckung des Aroms schnell ausbreitet.
Kann Ihnen dienen: Was ist der magnetische Moment??Andererseits haben diese intermolekularen Kräfte die Möglichkeit, ihre Wirkung auszuüben.
Wenn ein Gas in den flüssigen Zustand übergeht, nimmt sein Volumen ab, da der Abstand zwischen seinen Partikeln abnimmt und noch mehr, wenn es fest wird.
Materie im flüssigen Zustand
Im flüssigen Zustand sind intermolekulare Kräfte nicht verabscheuungswürdig, sondern wirken kleiner als im Festkörper. Die Partikel bilden kleine Gruppen, die sich kontinuierlich auflösen und sich neu gruppieren, was dem Material Mobilität liefert, obwohl ein festes Volumen beibehalten wird.
Diese Mobilität ermöglicht die Anpassung an die Form des Behälter. Die Diffusion kann auftreten, aber langsamer als bei Gasen.
Trotzdem haben die Partikel genügend Zusammenhalt, so dass die Flüssigkeit in einem weiten Temperaturbereich inkompressibel bleibt.
Oberflächenspannung
Auf der Oberfläche der Flüssigkeit gibt es Moleküle, auf die unausgeglichene intermolekulare Kräfte wirken, was zu einer Nettokraft führt. Diese Nettokraft wird minimiert, wenn die Flüssigkeit die niedrigstmögliche Oberfläche hat.
Dank dieser Kraft gelangen Stifte, Clips, Insekten und andere kleine Objekte, ohne zu sinken.
 In diesem Bild kann ein Molekül auf der Oberfläche der Flüssigkeit zu sehen sein, auf der eine Nettokraft wirkt, wodurch das Insekt auf dem Wasser gehen kann, ohne zu sinken
In diesem Bild kann ein Molekül auf der Oberfläche der Flüssigkeit zu sehen sein, auf der eine Nettokraft wirkt, wodurch das Insekt auf dem Wasser gehen kann, ohne zu sinken Solide staatliche Angelegenheit
Im festen Zustand sind die Partikel sehr nahe beieinander, und die intermolekularen Kräfte lassen die Partikel in festen Positionen bleiben. Obwohl sie um diese Position herum vibrieren können, nehmen Feststoffe eine definierte Form an und behalten ihr konstantes Volumen bei.
Wenn Wärme fließt, nimmt die Amplitude der Schwingungsbewegung zu und die Temperatur steigt. Dies führt dazu Wärmeleitdilatation. Wenn genügend Wärme fließt, kann der Feststoff sogar in die flüssige Phase gehen.


