Quantenmechanikmodell des Atoms

- 3099
- 300
- Said Ganzmann
Was ist das quantenmechanische Modell des Atoms??
Er Quantenmechanikmodell des Atoms Es geht davon aus, dass dies durch einen zentralen Kern gebildet wird, der von Protonen und Neutronen gebildet wird. Die Elektronen der negativen Belastung wickeln den Kern in diffuse Regionen, die als Orbitale bezeichnet werden.
Die Form und Ausdehnung der elektronischen Orbitale wird durch mehrere Größen bestimmt: das Kernpotential und quantisierte Energie- und Winkelimpuls von Elektronen.
 Abbildung 1. Modell eines Heliumatoms nach Quantenmechanik. Es besteht aus der Wahrscheinlichkeitswolke der beiden Heliumelektronen, die einen positiven Kern 100 Tausendmal kleiner umgeben. Quelle: Wikimedia Commons.
Abbildung 1. Modell eines Heliumatoms nach Quantenmechanik. Es besteht aus der Wahrscheinlichkeitswolke der beiden Heliumelektronen, die einen positiven Kern 100 Tausendmal kleiner umgeben. Quelle: Wikimedia Commons. Nach Quantenmechanik haben Elektronen das Verhalten mit zwei Wellenpartikeln und die Atomskala sind diffus und nicht spezifisch. Die Dimensionen des Atom.
Abbildung 1 zeigt die Struktur des Helium -Atoms, das einen Kern mit zwei Protonen und zwei Neutronen hat. Dieser Kern ist von der Wahrscheinlichkeitswolke der beiden Elektronen umgeben, die den Kern umgeben, der einhunderttausendmal kleiner ist. Im folgenden Bild können Sie das Helium -Atom mit den Protonen und Neutronen im Kern und Elektronen in Orbitalen sehen.

Die Größe eines Heliumatoms ist in der Größenordnung von a Angstrom (1 Å), das ist 1 x 10^-10 m. Während die Größe seines Kerns in der Größenordnung von a ist Femtometer (1 fm), das ist 1 x 10^-15 m.
Obwohl es vergleichsweise so klein ist, sind 99,9% des Atomgewichts im winzigen Kern konzentriert. Dies liegt daran, dass Protonen und Neutronen 2.000 -mal schwerer sind als die Elektronen, die sie umgeben.
Kann Ihnen dienen: Die 31 Arten von Kraft in der Physik und deren EigenschaftenAtomskala und Quantenverhalten
Eines der Konzepte, das den größten Einfluss auf die Entwicklung des Atommodells hatte, war das der Dualität Welle - Partikel: Die Entdeckung, dass jedes materielle Objekt eine Welle von Materie zugeordnet ist.
Die Formel, die es ermöglicht, die Wellenlänge zu berechnen λ Mit einem materiellen Objekt wurde Louis de Broglie 1924 vorgeschlagen und ist wie folgt:
λ = h / (m v)
Wo H Es ist Plancks Konstante, M der Teig und v Geschwindigkeit.
Nach De Broglies Prinzip hat jedes Objekt ein doppeltes Verhalten, aber abhängig von der Skala von Wechselwirkungen, Geschwindigkeit und Masse kann das Wellenverhalten herausragender sein als Partikel oder umgekehrt umgekehrt.
Das Elektron ist leicht, seine Masse beträgt 9,1 × 10^-31 kg. Die typische Geschwindigkeit eines Elektrons beträgt 6000 km/s (fünfzig Mal weniger als die Lichtgeschwindigkeit). Diese Geschwindigkeit entspricht den Energiewerten im Bereich von Dutzenden von Elektronenspannungen.
Mit den vorherigen Daten und unter Verwendung der De Broglie -Formel kann die Wellenlänge für das Elektron erhalten werden:
λ = 6,6 x 10^-34 J s / (9,1 × 10^-31 kg 6 x 10^6 m / s) = 1 x 10^-10 m = 1 Å
Das Elektron zu den typischen Energien der Atomniveaus hat eine Wellenlänge der gleichen Größenordnung wie das der Atomskala, so dass es in dieser Skala adulatorisch und nicht das Partikelverhalten hat.
Erste Quantenmodelle
Angesichts der Idee, dass das Atom -Skala -Elektron ein welliges Verhalten hat, wurden die ersten Atommodelle auf der Grundlage von Quantenprinzipien entwickelt. Unter diesen fällt das Atommodell von Bohr auf, was das Wasserstoffemissionsspektrum perfekt vorhergesagt hat, aber nicht das anderer Atome.
Kann Ihnen dienen: Spannungsaufwand: Formel und Gleichungen, Berechnung, ÜbungenBohrs Modell und anschließend das von Sommerfeld waren semi-klassische Modelle. Das heißt, das Elektron war ein Teilchen, das der elektrostatischen Anziehungskraft des Kerns ausgesetzt war, der sich um ihn herum umkreist, das dem zweiten Gesetz von Newton bestimmt wurde.
Zusätzlich zu den klassischen Umlaufbahnen berücksichtigten diese ersten Modelle, dass das Elektron eine zugehörige Materialwelle hatte. Es waren nur die Umlaufbahnen zulässig.
Dann erscheint die Quantisierung der Energie in der Atomstruktur zum ersten Mal.
Das Wort Quanten Genau aus der Tatsache, dass das Elektron nur einige diskrete Energiewerte innerhalb des Atoms einnehmen kann. Dies fällt mit Plancks Befund zusammen, der aus der Entdeckung bestand, dass eine Frequenzstrahlung F Interagieren Sie mit Materie in Energiepaketen E = h f, Wo H Es ist Plancks Konstante.
Orbitalform und Größe
Der radiale Bereich des Orbitals wird durch die bestimmt Radi -Wellenfunktionzum. Ist größer, soweit die Energie des Elektrons wächst, dh in dem Maße, in dem die Hauptquantenzahl zunimmt.
Der radiale Abstand wird normalerweise in BOHR-Funkgeräten gemessen, die für die niedrigste Wasserstoffenergie 5,3 × 10-11 m = 0,53 Å beträgt.
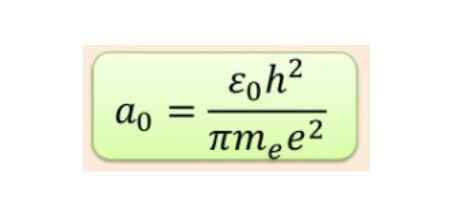 Figur 2. Bohr Radius Formel. Quelle: f. Zapata.
Figur 2. Bohr Radius Formel. Quelle: f. Zapata. Die Form der Orbitale wird jedoch durch den Wert der Quantenzahl der Winkelimpuls bestimmt. Wenn L = 0 ein kugelförmiges Orbital namens S haben, wenn L = 1 ein gelapptes Orbital aufgerufen hat P, Dies kann drei Orientierungen entsprechend der magnetischen Quantenzahl haben. Die folgende Abbildung zeigt die Form der Orbitale.
Kann Ihnen dienen: Vektorgröße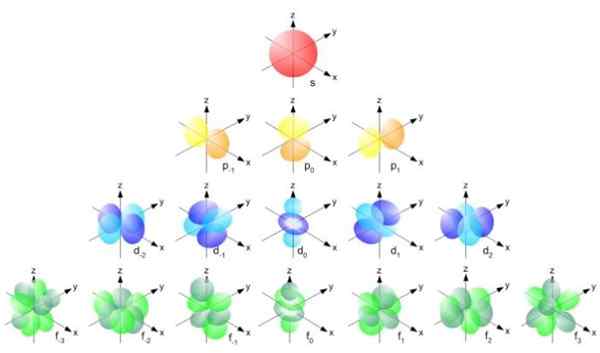 Figur 3. Form der Orbitale s, p, d, f. Quelle: UCDavis Chemwiki.
Figur 3. Form der Orbitale s, p, d, f. Quelle: UCDavis Chemwiki. Diese Orbitale werden in anderen gemäß der Energie der Elektronen verpackt. Beispielsweise zeigt die folgende Abbildung die Orbitale in einem Natriumatom.
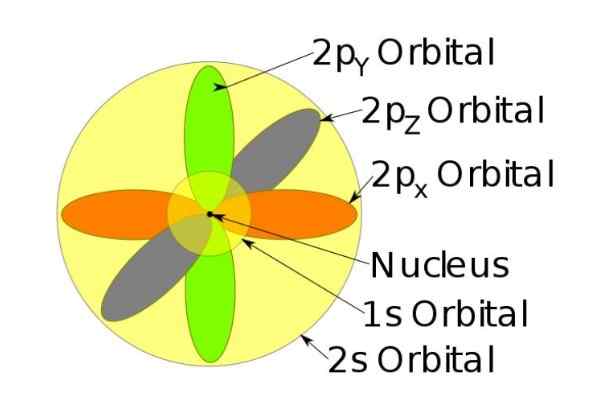 Figur 4. Orbitale 1s, 2s, 2p des Natriumionen, wenn es ein Elektron verloren hat. Quelle: Wikimedia Commons.
Figur 4. Orbitale 1s, 2s, 2p des Natriumionen, wenn es ein Elektron verloren hat. Quelle: Wikimedia Commons. Der Spin
Das quantenmechanische Modell der Schrödinger -Gleichung enthält nicht den Elektronenspin. Pauli wird jedoch durch das Ausschlussprinzip berücksichtigt, was darauf hinweist.
Zum Beispiel hat das Natriumion 10 Elektronen, dh, wenn wir uns auf die vorherige Abbildung beziehen, gibt es für jedes Umlaufraum zwei Elektronen.
Aber wenn es das neutrale Natriumatom ist, gibt es 11 Elektronen, von denen das letzte ein 3S -Orbital einnehmen würde (nicht in der Figur und im größeren Radius als die 2s). Der Spin des Atoms ist in den magnetischen Eigenschaften einer Substanz entscheidend.
Verweise
- Alonso - Finn. Quanten- und statistische Grundlagen. Addison Wesley.
- Eisberg - Resnick. Quantenphysik. Limusa - Wiley.
- Gasiorowicz. Quantenphysik. John Wiley & Söhne.
- HSC. Physikkurs 2. Jacaranda Plus.
- Wikipedia. Schrodinger Atomic Model. Erholt von: Wikipedia.com

