Atommodelle
- 3782
- 932
- Lewis Holzner
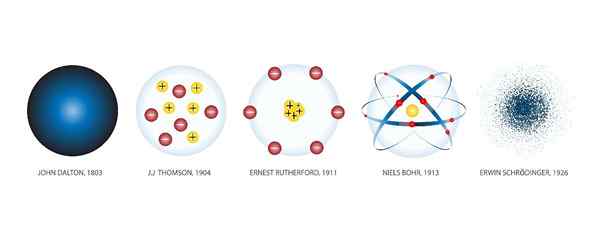
 Atommodelle sind die verschiedenen grafischen Darstellungen, die Atomen im Laufe der Geschichte gegeben wurden. Shuttersock
Atommodelle sind die verschiedenen grafischen Darstellungen, die Atomen im Laufe der Geschichte gegeben wurden. Shuttersock Was sind Atommodelle?
Der Atommodelle Sie sind grafische Darstellungen der Struktur und des Betriebs eines Atoms. In der Geschichte gab es zahlreiche Modelle.
Dies liegt daran, dass die Idee des Atoms als grundlegende Block. Zu dieser Zeit war das Atom nur ein Produkt philosophischer Spekulationen.
Als neue wissenschaftliche Entdeckungen gemacht wurden, wurden neue Modelle erstellt, um das erworbene Wissen einzubeziehen. Und so ist es bis heute Jahrhundert nach Jahrhundert passiert, als die Technologie es uns ermöglicht hat, Atome durch Mikroskope zu beobachten und das richtige Modell zu bestimmen.
Was sind Atome?
Die Atome sind submikroskopisch.
Auch die Sonne, der Mond, die Planeten, die Sterne und die Galaxien werden mit Atomen gebildet.
Diese sind so klein, dass sie nicht mit gemeinsamen Mikroskopen gesehen werden können. Andere werden von größerer Leistung verlangt, die als Ultramikroskope bezeichnet wird. Atome sind jedoch nicht die kleinsten Natureinheiten.
Atome werden wiederum von noch kleineren Partikeln gebildet: Protonen, Neutronen und Elektronen.
Protonen haben eine positive elektrische Ladung, während Neutronen keine elektrische Ladung haben. Diese beiden Partikelarten bilden den Kern des Atoms.
Um den Kern wie Planeten um die Sonne zu drehen, sind Elektronen, die eine negative elektrische Ladung haben.
Atommodell von Demokrit

Demokrit von Abdera war ein griechischer Philosoph, der zwischen 460 und 370 vor der gegenwärtigen Zeit lebte. Er bestätigte, dass alle Materie durch winzige Partikel gebildet wurden, die er Atome nannte, was in Griechisch unteilbar bedeutet.
Laut Democritus ist das Atom der kleinste Teil, in dem die Angelegenheit geteilt werden kann. Es gibt eine unendliche Anzahl von ihnen, die unzerstörbar, unglaublich, ewig und absolut kompakt sind, ohne Poren. Es gibt verschiedene Arten, die sich nach Form, Größe, Position und der Art, wie sie bereit sind, unterscheiden.
Es kann Ihnen dienen: Katastrophen, die durch den Menschen bei der Verwendung von Wissenschaft und Technologie verursacht werdenDemokritus 'Theorie wurde von Aristoteles abgelehnt und dann bis zur Entstehung der modernen Wissenschaft völlig vergessen.
Dalton Atomic Model

John Dalton (1766-1844) war ein englischer Meteorologe, der daran interessiert war, die Gesetze zu untersuchen, die das Gasverhalten regeln. Frucht seiner Arbeit in diesem Bereich war das erste Atommodell der modernen Wissenschaft, das er 1803 gemacht hat.
Da die Existenz von Protonen und Elektronen noch nicht entdeckt worden war, sagte Dalton wie Democritus, dass das Atom der kleinste Teil ist, in dem Materie geteilt werden kann und daher an sich unteilbar ist.
Laut Dalton sind Atome solide und haben eine kugelförmige Form, wie ein Baseballball. Dalton illustrierte zusammen mit seinen Assistenten, Dutzende Kugeln, die Atome verschiedener chemischer Elemente darstellten, seine Theorie in Holz, zusammen mit seinen Assistenten.
Dieses Modell war bis zur Entdeckung des Elektrons in Kraft.
Thomson Atomic Model
Der englische Physiker Joseph John Thomson (1865-1940) musste eine der wichtigsten Entdeckungen der modernen Wissenschaft machen: die des Elektrons.
Es war 1897 im Cavendish Laboratory der University of Cambridge in England, wo eine Plakette immer noch an die große Entdeckung erinnert.
Thompson und seine Assistenten projizieren eine Kathodenstrahlen auf einem elektrischen Feld. Nach dem Kontakt mit dem Feld wichen die Strahlen die Bildungsweitwinkel aus. Dies bestätigte, dass Kathodenstrahlen eine negative elektrische Ladung hatten. Diese negativ geladenen Partikel nannten sie Elektronen.
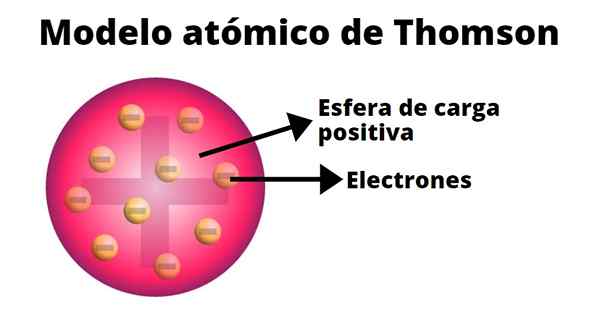
Thomson nahm an, dass die Elektronen in Atome eingebettet waren. Sein Atommodell stammt aus dem Jahr 1904.
Der Pudding von Rosinen
In Thompsons Atommodell ist das Atom eine feste Kugel mit einer positiven Belastung (Protonen), auf die Neutronen (negative Belastung) zufällig verteilt sind, wenn Rosinen auf Pudin geworfen werden. Deshalb war dieses Modell als "Pudin de Pasas" bekannt.
Laut Thompson hat das Atom einen Radius von 0,00000001 Zentimetern und seine Last ist neutral, da Protonen und Elektronen die gleiche Last haben, jedoch von entgegengesetztem Vorzeichen.
Das Thompson -Modell enthält keine Neutronen.
Rutherford Atomic Model
Ernest Rutherford (1871-1937), ein neozysischer Physiker, war einer der bekanntesten Studenten von Thomson.
Kann Ihnen dienen: Korrelationsforschung1911 und basierend auf der damals jüngsten Entdeckung der Radioaktivität führte Rutherford das folgende Experiment durch: Sie haben Alpha -radioaktive Partikel mit hoher Geschwindigkeit und Energie gegen ein Blatt Gold abgefeuert.
Wenn das Thompson -Atommodell korrekt wäre. Als sie jedoch den Abweichungswinkel von den Partikeln berechneten, entdeckten sie, dass er breit war und dass einige sogar gegen das goldene Blatt springen.
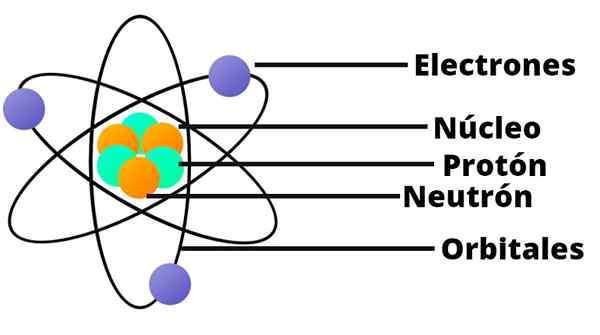
Mit diesem Ergebnis verstand Rutherford, dass das Atom einen sehr kleinen und stark kondensierten Kern haben sollte. Dieser Kern wurde positiv aufgeladen.
Ein kleines Sonnensystem
Rutherfords Atommodell ist wie ein Miniatur -Sonnensystem. In der Mitte gibt es an dem Ort, der der Sonne entsprechen würde, den Kern mit seinen positiv beladenen Protonen. Um diese umkreisen als Planeten, gibt es zufällig verteilte Elektronen.
Rutherford stellte auch fest, dass die Masse des Atoms der Summe der Elektronen- und Protonenmassen entspricht.
BOHR -Atommodell
Obwohl das Rutherford -Modell in Bezug auf frühere Modelle ein unbestreitbarer Fortschritt war, hatte es wichtige Mängel. Wenn die Elektronen beispielsweise um den Kern um den Kern umgehen, verlieren sie am Ende Energie und kollabieren am Kern. Aber das ist offensichtlich nicht geschehen.
Es war der dänische Physiker Niels Bohr (1885-1962), ein Student von Rutherford an der Universität von Manchester (England), der 1913 ein Atommodell vorschlug, das die Probleme löste, die sein alter Professor aufwiesen.
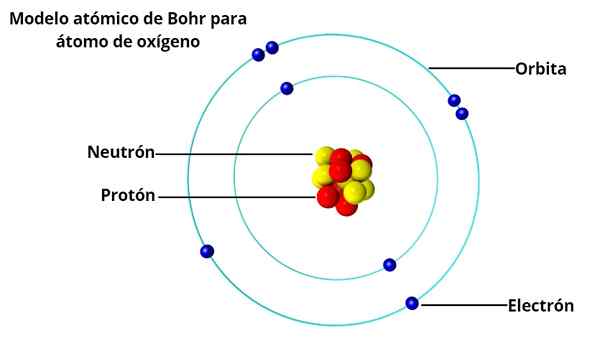
Kreislaufbahnen
Im Atommodell von BOHR drehen sich die Elektronen nicht frei um den Kern, sondern in stabilen kreisförmigen Umlaufbahnen, die durch einen bestimmten Abstand voneinander getrennt sind, ähnlich wie die Planeten des Sonnensystems angeordnet sind. Jede Umlaufbahn wird als Energie- oder Energieniveau bezeichnet.
Basierend auf den Untersuchungen von Max Planck und Albert Einstein stellte er fest, dass jedes Elektron in seiner Umlaufbahn eine gewisse Energie hat.
Während Sie stabil um den Kern umkreisen, wird gesagt, dass sich Elektronen im stationären Zustand befinden. Andererseits gibt es ein Photon, wenn ein Elektron zu einer niedrigeren Energieumlaufbahn "springt".
Kann Ihnen dienen: MethodikDas Bohr -Modell war jedoch nicht erfolgreich, um den Betrieb von Atomen mit mehr als einem Elektron zu erklären.
Sommerfeld Atommodell
Arnold Sommerfeld (1868-1951) war ein deutscher Physiker, der seine Arbeit dem Ausbau von Bohrs Atommodell widmete. Dieses erweiterte Modell wurde 1916 vorgestellt.
Basierend auf Einsteins Relativitätstheorie stellte Sommerfeld fest, dass einige Elektronen bei Geschwindigkeiten in der Nähe von Licht um den Kern umkreisen (300.000 Kilometer pro Sekunde).
Er nahm auch die folgenden Änderungen am Bohr -Modell vor:
- Die Elektronen bewegen sich in kreisförmigen und elliptischen Umlaufbahnen um den Kern. Bohr erkannte nur kreisförmige Umlaufbahnen.
- Innerhalb des gleichen Energieniveaus gibt es Sub -Levels mit leicht unterschiedlichen Energien.
Quantenmechanikmodell (Broglie, Heisenberg und Schrödinger)
Dies ist das genaueste Atommodell, das mit einigen nachfolgenden Ergänzungen bekannt ist und derzeit akzeptiert wird. Es wurde von drei Wissenschaftlern entwickelt: der deutsche Werner Heisenberg (1901-1976), der österreichische Erwin Schrödinger (1887-1961) und der Franzose Louis de Broglie (1892-1987).
Dieses Modell leitet die Idee von Elektronen ab, die den Kern umkreisen. Stattdessen haben wir elektronische Wolken, die Räume um den Kern sind, in dem es möglich ist, ein Elektron zu finden. Dies verhält sich wie eine stationäre Welle.
Die Wahrscheinlichkeit, dass es feststellt, wird mit einer von Schrödinger festgelegten Gleichung berechnet.
Dies ist das quantenmechanische Modell des Atoms, das aus der Schrödinger -Gleichung begann. Mit dieser Gleichung können Sie die Wahrscheinlichkeit kennen, ein Elektron an einem bestimmten Punkt eines Atoms zu finden.
In diesem Modell bewegt sich jede Elektron.
Es gibt keine zwei Elektronen, die identische Quantenzahlen besitzen, wie das Ausschlussprinzip von Physiker Wolfgang Pauli entdeckt hat.
Verweise
- (2010). Atom. Moderne Enzyklopädie Britisch.
- (S. F.). Democritus Atomic Model, Philosophischer Atomismus. Aus Energie-Nuklear genommen.Netz.
- (S. F.). Sommerfeld Atommodell, Expansion auf das Bohr -Modell. Aus Energie-Nuklear genommen.Netz.
- Bertsch, g. F.; Trefil, James und McGrayne, Sharon Bertsch (2021). Atom. Britannica Encyclopedia. Entnommen aus Britannica.com.
- Duignan, geb. (2021). Demokrit. Britannica Encyclopedia. Entnommen aus Britannica.com.
- New World Encyclopedia -Mitwirkende. (2021). Atom. Entnommen aus Newworldyclopedia.Org.
- Zita, Ana. (S. F.). Atommodelle. Entnommen aus Todamateria.com.

