Nachsichtsmodifikationen
- 4958
- 741
- Tizian Liebich
Was sind post -translationale Modifikationen?
Post -translationale Modifikationen sind reversible oder irreversible Modifikationen oder chemische Veränderungen.
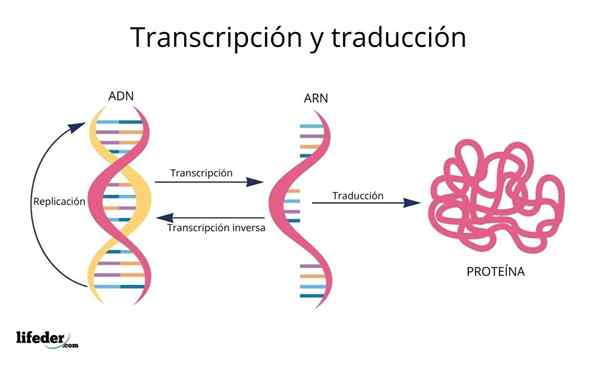
Die Übersetzung ist das Ergebnis der "Lesen und Interpretation" der in den Genen enthaltenen Informationen im eukaryotischen Kern (tritt auch in Prokaryoten auf).
Das Gensatz einer Zelle -Genom- Hier sind die Anweisungen, alle strukturellen Proteine und die Enzyme zu produzieren, die im zellulären Innenraum gefunden werden, von denen die Prozesse und Lebensfunktionen jeder Zelle abhängen.
Die Gene werden durch DNA (Desoxyribonukleinsäure) gebildet, eine Makromolekül Stickstoffbasen, Nämlich: Adenina, Timina, Guanina und Cytosin.
DNA ist also eine Art Art von Alphabet Mit Informationen, die gelesen und übersetzt werden.
Vor der Übersetzung sind Informationen in der DNA zuerst transkribiert Innerhalb des Kerns zu einem anderen sehr ähnlichen Molekül, RNA (Ribonukleinsäure), in Form von genannten Molekülen Messenger -RNA, die später zum Cytosol transportiert werden.
RNA ist der DNA sehr ähnlich, wird jedoch durch eine einzelne Kette gebildet, die aus Adenin-, Uracil-, Guanin- und Cytosin -Stickstoffbasen besteht.
Die Messenger -RNAs, die aus den genetischen kodierenden Proteinsequenzen abgeleitet sind, werden anschließend "gelesen" und ihre Sequenz ist übersetzt in den Peptidsequenzen von Zellproteinen mit Hilfe von Ribosomen und anderen RNA -Molekülen, die als RNA übertragen das, wie der Name schon sagt, Sie übertragen Die Aminosäuren, die dem Protein entsprechen, das synthetisiert wird.
Die Reihenfolge, in der diese Aminosäuren in den entstehenden Proteinen zugegeben werden.
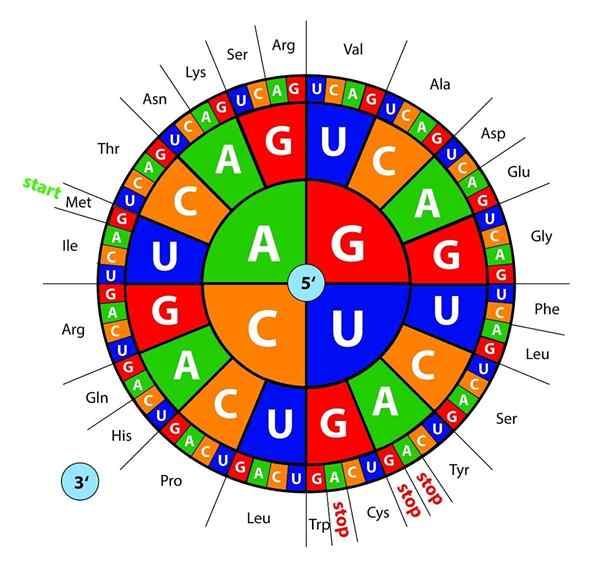
DNA -Basen, transkribiert als RNA, werden von Ribosomen in Trios oder Drillingen "gelesen" genannt Codons, jeder von denen Codes für eine der 20 Aminosäuren, mit denen Proteine gebildet werden; Hier ist das genetischer Code wird interpretiert, um gleichzeitig eine Aminosäure in der richtigen Reihenfolge einzuführen.
Post -translationale Modifikationen
Die meisten physikochemischen und funktionellen Eigenschaften jedes Proteins hängen hauptsächlich von den in der DNA codierten Informationen ab.
Die Zellen schaffen es jedoch, die Vielfalt ihrer Proteine signifikant durch post -translationale Modifikationen zu erhöhen, die nichts anderes als chemische Modifikationen sind - durch Enzyme -, die nach ihrer Translation einige Proteine erleiden.
Es kann Ihnen dienen: Oxidase -Glukose: Eigenschaften, Struktur, FunktionenDaher können die Eigenschaften einiger Proteine nicht nur aus der Aminosäuresequenz abgeleitet werden, die sich aus genetischen Informationen ergibt.
Diese Modifikationen treten im Allgemeinen bei Aminosäureabfällen auf, die vorgehen.
Es wurden mehr als 500 post -translationale Modifikationen beschrieben, von denen jedoch die bekanntesten und untersuchten Phosphorylierung, die Bildung von Disulfidbrücken, Methylierung, Acetylierung, Hydroxylierung, Glykosylierung, Pränilierung, Ubiquitinierung und Carboxylierung sind.
POSTRADISALE -Modifikationsprozess
Die post -translationalen Modifikationen sind, wie wir kommentiert haben.
Sie haben im Allgemeinen mit der Zugabe chemischer Gruppen und/oder der Modifikation von Aminosäureabfällen, aus denen Proteine besteht von Aminosäuren o Peptidezeichen durch Schnitte oder Clivajes proteolytisch.
Diese Modifikationen sind aufgrund des Vorhandenseins bestimmter spezialisierter zellulärer Enzyme und zusätzlich kleine Energiesubstrate möglich - sie sind keine spontanen Reaktionen - zum Beispiel:
- Das ATP (Adenosin 5-Phosphat)
- Acetyl-Coenzym A (Acetyl-Co-A)
- Das NAD+ (5'-Nicinamid 5'-Diphosphat-Adenosin)
- S-adenosil metionina (sam)
- Das 5'-Diphosphat Uracil N-Acetylglucosamin (UDP-GRCNAC)
- Uracil 5'-Glucose-Diphosphat (UDP-Glucose)
- Unter anderen
Einige der wichtigsten post -translationalen Modifikationen wirken als Schalter (Suiches) Molekular, das die enzymatischen Funktionen einiger Proteine aktiviert oder deaktiviert und ihre Zellfunktion oder sogar ihre intrazelluläre Position reguliert.
Zum Beispiel werden viele Proteine, die zu intrazellulären Organellen gehören Signalsequenzen, die von anderen Proteinen erkannt werden, die dafür verantwortlich sind, sie in das entsprechende Kompartiment zu leiten, und unterwegs werden diese Signale normalerweise aus der Proteinstruktur entfernt.
Ein weiteres sehr auffälliges Beispiel für post -translationale Modifikationen, die mit proteolytischen Clivaje zu tun haben.
Konjugierte Proteine
Obwohl sie nicht immer als solche erkannt werden, sind andere sehr wichtige post -translationale Modifikationen diejenigen, die die Bildung von Proteinen beinhalten, deren Struktur aus einer oder mehreren Peptidketten besteht vorübergehend.
Im Allgemeinen werden diese Proteine nach der Identität der Nicht -Protein -Fraktion klassifiziert und benötigen solche Teile, um ihre Funktionen auszuführen.
Es kann Ihnen dienen: BlutagarDiese Brüche oder Teile sind als bekannt als Prothetische Gruppen Und ein gutes Beispiel für diese Proteine ist Hämoglobin, das mit einer Hämogruppe verbunden ist.
Endoplasmatisches Retikulum in Aktion
Viele post -translationale Modifikationen beginnen im rauen endoplasmatischen Retikulum, wo assoziierte Ribosomen Proteine übersetzen, wenn sie in die Membran dieser Organelle eingeführt werden.
Im endoplasmatischen Retikulum erwerben viele Proteine ihre endgültige strukturelle Konformation: Ihre Signalsequenzen werden entfernt, in der richtigen Form falten, Disulfurbrücken werden gebildet, zuckerhaltige Gruppen usw. werden usw.
Arten von post -translationalen Modifikationen
In eukaryotischen Zellen wurden mehr als 500 Arten unterschiedlicher post -translationaler Modifikationen beschrieben; Die folgende Liste gruppiert einige der am meisten untersuchten:
-
Phosphorylierung
Übertragung einer oder mehrerer Phosphatgruppen aus hohen Energiemolekülen wie ATP in Richtung der Aminosäurehydroxylgruppe wie Serin, Treonin und Tyrosin; Es wird durch die Enzyme der Gruppe der vermittelt Männer Proteine (Diese Phosphate werden durch Enzyme entfernt Phosphatasen).
Es ist wichtig bei zahlreichen Zellereignissen wie Teilung, Signaltransduktion, Kohlenhydratmetabolismus, Zellwachstum und Zellzyklusfortschritt.
-
Schwefelation
Dies ist die Zugabe einer Gruppe -SO3H (sulfonisch) ausschließlich im Abfall der Tyrosinaminosäure und ist typisch für transmembraale Proteine oder Proteine, die ausgeschieden werden. Es wird durch Tyrosil-Sulfotransferase-Enzyme katalysiert.
Es ist ein wichtiger Prozess für das Funktionieren vieler membranaler Rezeptoren, für bestimmte Arten von intrazellulären Beschilderungen usw.
-
Disulfurbrückenbildung zwischen Cysteinen
Dieser Prozess tritt zwischen Cysteinresten auf und ist eine der wichtigsten post -translationalen Modifikationen aus struktureller Sicht. Die Disulfidbrücken werden in Organellen wie dem Golgi -Komplex und dem endoplasmatischen Retikulum festgelegt, die oxidierende Umgebungen haben.
Diese post -translationale Modifikation hat mit der Einrichtung einer bestimmten strukturellen Konfiguration zu tun, die normalerweise für die Aktivität zahlreicher Enzyme sehr wichtig ist.
-
Methylierung
Es besteht aus der Zugabe von Methylgruppen in Aminosäuren wie Lysin, Arginin, Histidin, Glutamin und Asparagin (N-Methylierung) wie Aspartat und Glutamat (O-Methylierung) oder als Cystein (S-Methylierung).
Es kommt dank der katalytischen Wirkung von Enzymen, die als N-, O- oder S-Methyltransferasen bekannt sind. Die Proteinmethylierung ist für die Regulation der genetischen Transkription auf Histonproteinebene wesentlich, spielt aber auch eine geringere Rolle bei der Signaltransduktion.
-
Acetylierung
Es impliziert die Zugabe von Acetylgruppen zu Lysinresten einiger Proteine. Es wird durch Acetyltransferase -Enzyme katalysiert und hat auch sehr wichtige Funktionen aus Sicht der Regulation der genetischen Expression (auf der Ebene von Histonproteinen, die an DNA binden).
-
Hydroxylierung
Es tritt normalerweise in Prolin-, Lysin- und Asparaginabfällen auf und wird durch eisenabhängige Hydroxylase-Enzyme katalysiert. Die resultierenden Aminosäuren, Hydroxyprol und Hydroxilisin sind sehr wichtig für die Reifung einiger Proteine (einschließlich Kollagen) sowie für einige Antibiotika- und Antimykotika (Hydroxiasparagin) (Hydroxiasparagin).
-
Glykosylierung
Diese Modifikation ist ein sehr wichtiger Prozess für eukaryotische Zellen. Es tritt hauptsächlich auf Serin- und Asparaginabfällen auf, kann aber auch bei Hydroxyprolinen oder Hydroxilisins auftreten.
Es kann Ihnen dienen: Evolutionismus: Herkunft, Darwin, soziale, lineare und kulturelle EvolutionismusEs besteht aus der Zugabe von Kohlenhydratmolekülen zur Proteinstruktur und wird durch Glycosyltransferase -Enzyme katalysiert und tritt insbesondere in Ausscheidungsproteinen und in denen auf der Zelloberfläche auf.
-
Prenila
Es besteht aus dem Transfer von Isaprenilos (Lipid) -Gruppen zu einigen Proteinen. Die zuständigen Enzyme sind spezifische Übersetzungen für jede Gruppe.
Dieser Prozess ist wichtig für die Verankerung eines Proteins an Zellmembranen, tritt aber auch während der Signaltransduktion usw. auf.
-
Ubiquitinierung
Dies ist die kovalente Zugabe von einem oder mehreren Kopien des Peptids bekannt als Ubiquitin. Diese Ergänzung Marke Proteine zum Abbau in einem Proteinkomplex bekannt als 26S Proteosom.
Es ist ein sehr effizientes intrazelluläres Regulationssystem und ist dafür verantwortlich.
Beispiele
Phosphorylierung und Glysilation sind zwei äußerst wichtige post -translationale Modifikationen für die Zellleben. Nicht nur, weil sie viele Prozesse im Zusammenhang mit Kommunikation und Zellzyklus kontrollieren, sondern auch, weil sie bei Eukaryoten sehr häufig sind.
P53 -Protein ist zum Beispiel ein Protein, das als "Tumorsuppressor" bekannt ist, das bei einigen Krebsbehandlungen verwendet wird. Seine Aktivierung hängt von der Wirkung verschiedener Kinase-Proteine ab, die für die Phosphorylierung seines N-terminalen Ende verantwortlich sind.
Andererseits enthält die eukaryotische Zelloberfläche eine große Anzahl von Glykoproteinen (post -translationale modifizierte Proteine durch Zugabe von Kohlenhydraten).
Viele dieser Proteine haben unter anderem wichtig.
Verweise
- Alberts, geb., Bray, d., Hopkin, k., Johnson, a. D., Lewis, J., Raff, m.,… & Walter, P. (2015). Essentielle Zellbiologie. Garlandwissenschaft.
- Cox, m. M., & Nelson, D. L. (2008). Lehninger Prinzipien der Biochemie. Während Freeman.
- Garrett, r. H., & Grisham, C. M. (1999). Biochemie.
- Grün, k. D., & Garneau-tesodikova, s. (2010). Posttranslationale Modifikation von Proteinen.
- Walsh, c. T., Garneau ---seodikova, s., & Gatto jr, g. J. (2005). Post -translationale Proteinmodifikationen: Die Chemie der Proteom -Diversifizierungen. Angewandte Chemie International Edition, 44 (45), 7342-7372.