Molalität

- 4803
- 1555
- Jasmine Kupprion
Was ist Molealität?
Der Molalität, Mit dem Buchstaben M in Kleinbuchstaben bezeichnet, wird ein Begriff verwendet, der die Konzentration einer Lösung beschreibt. Es kann als die Anzahl der Mol eines gelösten gelösten gelösten gelösten gelösten Lösungsmittels definiert werden.
Es entspricht den Mol Stoff (der Substanz, die sich auflöst) geteilt durch die Lösungsmittelkilogramm (die zum Auflösen verwendete Substanz).

Wo gelöste Maulwürfe durch die Gleichung gegeben werden:
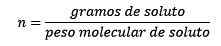
Am Ende bleibt die Moleit -Gleichung also bestehen
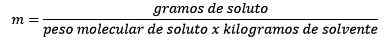
Eigenschaften der Molealität
- Molalität ist ein Maß für die Konzentration eines gelösten Stoffes in einer Lösung. Wird hauptsächlich verwendet, wenn die Temperatur ein Problem darstellt.
- Die Molalität ist nicht so häufig wie ihr Gegenstück, Molarität (Mol aus gelösten Lösungsmitteln), wird jedoch in sehr spezifischen Berechnungen verwendet, insbesondere in Bezug auf die koligativen Eigenschaften (Erhöhung des Siedepunkts, Depression des Gefrierpunkts). Da das Volumen aufgrund von Temperatur und Druck unterschiedlich unterliegt, variiert die Molarität auch je nach Temperatur und Druck.
- In einigen Fällen ist die Gewichtsnutzung von Vorteil, da die Masse nicht mit den Umgebungsbedingungen variiert.
- Es ist wichtig, dass die Lösungsmittelmasse und nicht die Masse der Lösung verwendet werden.
- Die mit moralischen Konzentration gekennzeichneten Lösungen sind mit einem Kleinbuchstaben m angezeigt. Eine 1,0 -m -Lösung enthält 1 Mol gelöste Stoff pro Kilogramm Lösungsmittel.
- Die Vorbereitung einer bestimmten Morallösung ist einfach, da sie nur eine gute Skala erfordert. Sowohl das Lösungsmittel als auch der gelöste Stoff werden gemischt, anstatt nach Volumen gemessen zu werden.
Es kann Ihnen dienen: Propanäure- Die SI -Einheit (internationales System) für Molität ist mol/kg oder Moles, die pro kg Lösungsmittel gelöst sind. Eine Lösung mit einer Molität von 1 mol/kg wird oft als "1 Maulwurf" oder "1 m" beschrieben.
Nach dem SI -Einheiten -System ist das Nationale Institut für Standards und Technologie, bei dem die Vereinigten Staaten zur Messung angegeben sind.
Unterschiede und Ähnlichkeiten zwischen Molealität (M) und Molarität (M)
Die Herstellung einer Lösung einer bestimmten Moral impliziert, dass sowohl der gelöste als auch das Lösungsmittel abgewogen und ihre Massen erhalten werden.
Im Falle von Molarität wird das Volumen der Lösung jedoch gemessen, wodurch der Raum für Dichteschwankungen infolge des Umgebungszustands und Druckzustands der Zustand bleibt.
Dies bedeutet, dass es einen vorteilhaften Druck ist, während der Teig unverändert bleibt.
Darüber hinaus finden chemische Reaktionen in Massenanteil und nicht in Volumen statt. Um sich auf den Teig zu verlassen, kann Molealität leicht zu einem Massenverhältnis oder zu einem Massenanteil werden.
Für wässrige Lösungen (Lösungen, in denen Wasser lösungsfähig ist) in der Nähe der Umgebungstemperatur ist der Unterschied zwischen moralischen und molaren Lösungen verabscheuungswürdig.
Dies liegt daran, dass Wasser um Umgebungstemperatur eine Dichte von 1 kg / l hat. Dies bedeutet, dass das "durch L" der Molarität dem "durch kg" der Molealität gleich ist.
Es kann Ihnen dienen: Calcium Casinat: Struktur, Eigenschaften, erhalten und verwendetFür ein Lösungsmittel wie Ethanol, bei dem die Dichte 0,789 kg / l beträgt, würde eine 1 m Lösung 0,789 m betragen.
Der wichtige Teil des Erinnerns an den Unterschied ist:
Molarität - M → Mol pro Liter Lösung.
Molalität - M → Mol pro Kilogramm Lösungsmittel.
Beispiele für Molealität
Beispiel 1
Problem: Was ist die Moral einer Lösung, die 0 enthält.086 Mol NaCl, gelöst in 25,0 g Wasser?
Antworten: In diesem Beispiel wird die direkte moralische Gleichung verwendet:
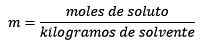
Mol aus gelösten Stoff (NaCl) = 0,086 mol
Masse (Wasser) = 25,0 g = 25,0 x 10-3 kg
Ersetzen Sie: Sie haben:
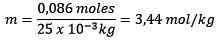
Beispiel 2
Problem: Was ist die Moral einer Lösung, wenn sich 124,2 Gramm Naoh in 1,00 Litern Wasser auflösen? (Die Wasserdichte entspricht 1,00 g/ml).
Antworten: Wasser wird als universelles Lösungsmittel und Dichte bezeichnet. Dies erleichtert die Umwandlung von Litern in Kilogramm.
In diesem Problem müssen die 124,2 Gramm NaOH in Maulwürfe (für Maulwürfe von gelösten) umgewandelt werden und ein Liter Wasser muss mit der Dichte in Kilogramm (durch Kilogramm Lösungsmittel) umgewandelt werden.
Erstens gibt es Naohs Molmasse:
P.MN / A= 22,99 g/mol
P.MENTWEDER= 16 g/mol
P.MH= 1 g/mol
P.MNaoh= 22,99 g/mol +16 g/mol +1 g/mol = 39,99 g/mol
Zweitens konvertieren NaOHs Gramm in Maulwürfe unter Verwendung des Molaren -Teigs:
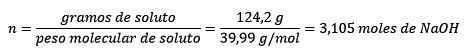
Drittens wird der Liter des Wassers mit Dichte zu Kilogramm:
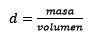
Den Teig räumen, bleibt:
Kann Ihnen dienen: Goldoxid (III) (AU2O3): Was ist, Struktur, Eigenschaften, verwendet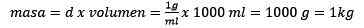
Schließlich wird die Molelismusgleichung gelöst:
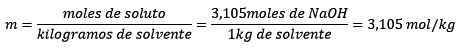
Beispiel 3
Problem: Was ist die Wassermasse einer wässrigen Lösung, die 0,52 Gramm Bariumchlorid enthält (BACL2, PM = 208,23 g/mol), deren Konzentration 0,005 mol/kg beträgt?
Antworten: In diesem Fall wird die moralische Konzentration verwendet, um die Wassermenge in Lösung zu bestimmen.
Erstens wird die Anzahl der Mol von BACL erhalten2 In der Lösung:
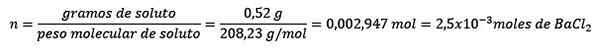
Zweiten.
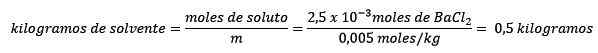
Verweise
- Berechnung des Beispielproblems der Molalität. Von wissenschaftlich geborgen.Org.
- Was ist ein Beispiel für Molalität? Von sokratisch erholt.Org.
- (S.F.). Moral. Von grenzenlos geborgen.com.

