Apolare Moleküle
- 3444
- 928
- Timo Rabenstein
Der Apolare Moleküle Sie sind diejenigen, die in ihrer Struktur eine symmetrische Verteilung ihrer Elektronen vorhanden sind. Dies ist möglich, wenn die Elektronegativitätsdifferenz seiner Atome gering ist oder wenn die Atome oder elektronegativen Gruppen ihre Auswirkungen auf das Molekül aufbrechen.
Nicht immer "Apolarität" ist absolut. Aus diesem Grund werden schlechte Polaritätsmoleküle als apolar angesehen; Das heißt, es hat ein Dipolmoment µ nahe 0. Hier betreten Sie das relative Feld: Wie niedrig sollte µ so sein, dass ein Molekül oder eine Verbindung als apolar angesehen wird?
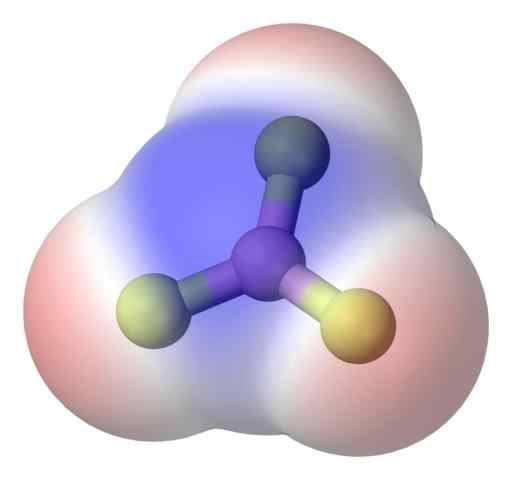
 BF3 apolares Molekül. Quelle: Benjah-BMM27 über Commons Wikimedia.
BF3 apolares Molekül. Quelle: Benjah-BMM27 über Commons Wikimedia. Um das Problem besser anzugehen, haben Sie das Bor Trifluorid -Molekül, BF3 (oberes Bild).
Das Fluoratom ist viel elektronegativer als Boro, und daher sind die B-F-Verbindungen polar. Das BF -Molekül3 Es ist symmetrisch (trigonale Ebene) und beinhaltet die Vektor-Stornierung der drei B-F-Momente.
Daher werden apolare Moleküle auch mit der Existenz von polaren Verbindungen erzeugt. Die erzeugte Polarität kann durch die Existenz eines anderen polaren Zusammenhangs in der gleichen Größe wie die vorherige ausbalanciert werden, aber in die entgegengesetzte Richtung orientiert; wie im bf der Fall3.
Eigenschaften eines apolaren Moleküls
Symmetrie
Damit die Auswirkungen polarer Verbindungen sich gegenseitig abbrechen, muss das Molekül eine bestimmte geometrische Struktur haben. Zum Beispiel linear, am einfachsten zu verstehen auf den ersten Blick.
Dies ist der Fall von Kohlendioxid (CO2) mit zwei polaren Links (o = c = o). Dies liegt darauf.
Kann Ihnen dienen: TransaminierungEines der ersten Eigenschaften, die berücksichtigt werden, wenn die „Apolarität“ eines Moleküls durch Vogelflug bewertet wird, besteht darin, zu beobachten, wie symmetrisch es ist.
Angenommen, anstelle von co2 Sie haben das Molekül Cos (o = c = s), Carbonylsulfid genannt.
Jetzt ist es kein apolares Molekül mehr, da die Schwefelelektronegativität weniger als Sauerstoff ist; Und daher unterscheidet sich das Dipolmoment C = S von der C = O. Infolgedessen ist das COS ein polares Molekül (das Polar ist ein Mehl eines anderen Sacks).
Das untere Bild fasst grafisch alles zusammen, was neu beschrieben ist:
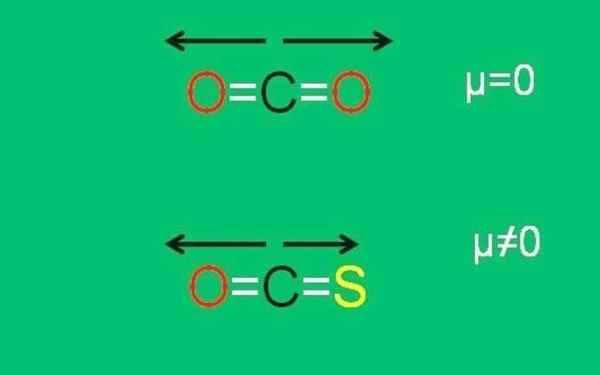 Xxx dipolare Momente der CO2- und COS -Moleküle. Quelle: Gabriel Bolívar.
Xxx dipolare Momente der CO2- und COS -Moleküle. Quelle: Gabriel Bolívar. Beachten Sie, dass das Dipolmoment des Links C = S kleiner als der Link C = O im COS -Molekül ist.
Elektronegativität
Die Elektronegativität auf der Paulingskala hat Werte zwischen 0,65 (für Francio) und 4,0 (für Fluorid). Im Allgemeinen haben Halogene eine hohe Elektronegativität.
Wenn der Unterschied in der Elektronegativität der Elemente, die eine kovalente Bindung bilden. Die einzigen Moleküle, die wirklich apolar sind, sind jedoch diejenigen, die durch Verbindungen zwischen identischen Atomen (wie Wasserstoff, H-H) gebildet werden, gebildet werden.
Intermolekularen Kräfte
Damit eine Substanz im Wasser auflöst, muss sie elektrostatisch mit den Molekülen interagieren; Wechselwirkungen, die keine apolaren Moleküle durchführen können.
In apolaren Molekülen sind ihre elektrischen Ladungen nicht an einem Ende des Moleküls beschränkt, sondern symmetrisch verteilt (oder homogen). Daher ist er nicht in der Lage, durch Dipol-Dipolo-Kräfte zu interagieren.
Kann Ihnen dienen: AtomvolumenStattdessen interagieren apolare Moleküle durch Londoner Dispersionskräfte miteinander; Dies sind sofortige Dipole, die die elektronische Wolke benachbarter Moleküle -Atome polarisieren. Hier ist die molekulare Masse ein vorherrschender Faktor in den physikalischen Eigenschaften dieser Moleküle.
Wie man apolare Moleküle identifiziert?
-Vielleicht ist eine die besten Methoden, um ein apolares Molekül zu identifizieren.
-Im Allgemeinen sind apolare Moleküle gasförmiger Natur. Sie können auch nicht mischbare Flüssigkeiten mit Wasser sein.
-Apolare Feststoffe sind durch weiche Bescheid gekennzeichnet.
-Die Dispersionskräfte, die sie zusammenhalten, sind normalerweise schwach. Aus diesem Grund sind seine Schmelz- oder Siedepunkte tendenziell niedriger als die von polaren Verbindungen.
-Apolare Moleküle, insbesondere in flüssiger Form, sind schlechte Stromleiter, da ihnen die elektrische Nettoladung fehlt.
Beispiele für apolare Moleküle
Edelgase
Obwohl es sich nicht um Moleküle handelt, gelten edle Gase als apolar. Wenn angenommen wird, dass zwei seiner Atome für einen kurzen Zeitraum interagieren, kann diese Wechselwirkung (halb) als Molekül betrachtet werden. Molekül, das apolare Natur wäre.
Diatommoleküle
Diatommoleküle wie h2, die Br2, das i2, Das Cl2, Das Ö2, und f2, Sie sind apolar. Diese sind im Allgemeinen2, A-a.
Kohlenwasserstoffe
Was wäre, wenn es eine Gruppe von Atomen wäre? Es würde vor anderen apolaren Verbindungen sein; Zum Beispiel Ethane, Cho3-CH3, dessen Kohlenstoffskelett linear ist, C-C.
Metano, Ch4, und das Ethan, c2H6, Sie sind apolare Moleküle. Kohlenstoff hat eine Elektronegativität von 2,55; Während die Wasserstoffelektronegativität 2,2 beträgt. Daher gibt es einen Dipolvektor mit geringer Intensität, der von Wasserstoff zu Kohlenstoff ausgerichtet ist.
Es kann Ihnen dienen: MoHR -Methode: Grundlagen, Reaktionen, Verfahren, verwendetAufgrund der geometrischen Symmetrie von Methan- und Ethanmolekülen ist jedoch die Summe der Dipolvektoren oder Dipolmomente in ihren Molekülen für nichtig.
Im Allgemeinen geschieht das Gleiche mit allen Kohlenwasserstoffen, und selbst wenn sie Ungesättigte (doppelte und dreifache Bindungen) enthalten, gelten sie als apolar. Auch zyklische Kohlenwasserstoffe sind apolare Moleküle wie Cyclohexan oder Cyclobutan.
Andere
Kohlendioxidmoleküle (CO2) und Kohlenstoffdisulfid (CS2) Sie sind apolare Moleküle, beide mit einer linearen Geometrie.
In Kohlenstoffdisulfid beträgt die Kohlenstoffelektronegativität 2,55, während die Schwefelelektronegativität 2,58 beträgt; So haben beide Elemente praktisch die gleiche Elektronegativität. Es gibt keine Erzeugung eines Dipolvektors und daher ist die Nettobelastung Null.
Außerdem sind die folgenden CCL -Moleküle verfügbar4 und Albr3, beide apolar:
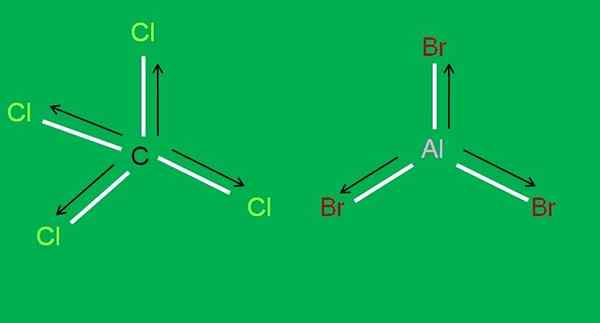 CCL4- und Albr3 -Moleküle. Quelle: Gabriel Bolívar.
CCL4- und Albr3 -Moleküle. Quelle: Gabriel Bolívar. In Aluminiumtribromid, ALBB3 Das gleiche passiert mit dem Freund3, Zu Beginn des Artikels. Inzwischen für Kohlenstofftetrachlorid CCL4, Die Geometrie ist tetraedrisch und symmetrisch, da alle C-Cl-Links gleich sind.
In ähnlicher Weise Moleküle mit der allgemeinen Formel CX4 (Vgl4, CI4 und CBR4), sie sind auch apolar.
Und schließlich kann ein apolares Molekül sogar oktaedrische Geometrie aufweisen, wie dies bei Schwefelhexafluorid, SF, der Fall ist6. In der Tat können Sie jede Geometrie oder Struktur haben, solange sie symmetrisch und ihre elektronische Verteilung homogen ist.
Verweise
- Nichtpolares Molekül. Erholt von: Chemie.Tutorvista.com
- Beispiel für polare und nichtpolare Moleküle. Erholt von: thoughtco.com
- « Gleichgewicht der Materie Was ist, allgemeine Gleichung, Typen
- Daniel Servitje Montull Biographie, Führung und Beiträge »

