Dipolarer Moment, wie es berechnet wird und Beispiele

- 3963
- 516
- Lewis Holzner
Er Dipolarem Moment Es ist eine chemische Eigenschaft, die angibt, wie heterogen die elektrischen Ladungen in einem Molekül verteilt sind. Es wird in Debye -Einheiten ausgedrückt, 3,33 · 10-30 C · m, und normalerweise reichen ihre Werte von 0 bis 11 d.
Hoch polare Verbindungen haben tendenziell große Dipolmomente; während der apolare, kleine Dipolmomente. Je polarisierter die elektrischen Ladungen in einem Molekül sind, desto größer ist ihr Dipolmoment. Das heißt, es muss eine Region geben, die reich an Elektronen, Δ- und einem weiteren Armen in Elektronen, Δ reicht+.
 Der Zwei -Color -Entwurf dient als Analogie zu zwei positiv und negativen Polen eines Moleküls mit einem ausgeprägten Dipolmoment. Quelle: Pexels.
Der Zwei -Color -Entwurf dient als Analogie zu zwei positiv und negativen Polen eines Moleküls mit einem ausgeprägten Dipolmoment. Quelle: Pexels. Das Dipolmoment μ ist eine Vektorgröße, daher wird es durch die Winkel der Glieder und im Allgemeinen durch die molekulare Struktur beeinflusst.
Wenn das Molekül linear ist, kann es mit einem zweigelenkten Entwurf verglichen werden. Sein negatives Ende δ- würde es der roten Farbe entsprechen; Während das Positive, Δ+, die blaue Farbe wäre. Wenn die Größen der negativen Belastungen im Δpol zunehmen, und der Abstand, der sie von Δ+trennt, nimmt das Dipolmoment zu.
Chemisch bedeutet das oben genannte, dass je größer der Unterschied in der Elektronegativität zwischen zwei Atomen ist, und je länger der Abstand, der sie trennt, desto größer ist das Dipolmoment zwischen ihnen.
[TOC]
Wie wird das Dipolmoment berechnet??
Es wird als kovalente Verbindung zwischen zwei Atomen A und B angesehen:
A-b
Der Abstand zwischen positiven und negativen partiellen Belastungen wird bereits durch die Länge seiner Verbindung definiert:
ZUδ+-Bδ-
Weil Protonen und Elektronen die gleiche Größe der elektrischen Ladung haben, jedoch mit entgegengesetzten Zeichen, 1.6 · 10-19C, Dies ist diejenige, die bei der Bewertung des Dipolmoments zwischen A und B durch die folgende Gleichung berücksichtigt wird:
Es kann Ihnen dienen: Unterschiede zwischen organischen und anorganischen Verbindungenμ = δ ·D
Wenn μ das Dipolmoment ist, ist δ die Last des Elektrons ohne negatives Vorzeichen und und D Die Länge des in Metern ausgedrückten Links. Zum Beispiel unter der Annahme dessen D Es hat einen Wert von 2 Å (1 · 10-10m) Das Dipolmoment μA-B ist:
μA-B = (1.6 · 10-19C) · (2 · 10-10M)
= 3,2 · 10-29Cm
Da dieser Wert jedoch sehr klein ist, wird die Deby -Einheit verwendet:
μ = (3,2 · 10-29C · m) · (1 d/3,33 · 10-30 Cm)
= 9,60 d
Dieser μA-B-Wert könnte davon ausgehen, dass die A-B-Verbindung ionischer als kovalent ist.
Beispiele
Wasser
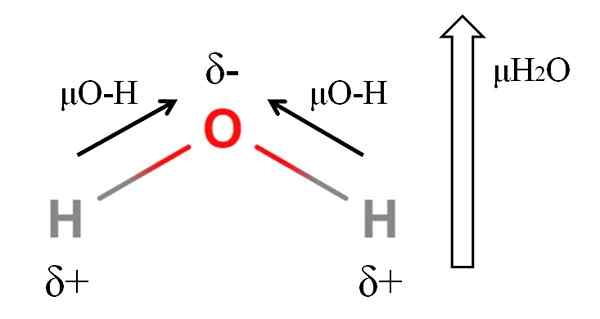 Dipoar -Moment eines Wassermoleküls. Quelle: Gabriel Bolívar.
Dipoar -Moment eines Wassermoleküls. Quelle: Gabriel Bolívar. Um das Dipolmoment eines Moleküls zu berechnen, müssen Sie alle Dipolmomente ihrer jeweiligen Verbindungen hinzufügen, wenn Sie die Winkel von Links und ein wenig Trigonometrie berücksichtigen. Das zunächst.
Wasser hat einen der größten Dipolmomente, die für eine kovalente Verbindung zu erwarten sind. Im oberen Bild haben wir, dass Wasserstoffatome positive partielle Belastungen Δ+haben, während der Sauerstoff die negative partielle Belastung δ trägt-. Der O-H-Link ist ziemlich polar (1.5d), und es gibt zwei von ihnen in einem H -Molekül2ENTWEDER.
Im Allgemeinen wird ein Vektor vom weniger elektronegativen Atom (H) bis zum elektronegativsten (O) gezogen. Obwohl sie nicht gezeichnet sind, gibt es auf dem Sauerstoffatom zwei Paare nicht gemeinsamer Elektronen, die die negative Region noch mehr "konzentrieren".
Aufgrund der Winkelgeometrie von H2Oder die Dipolmomente verbinden sich in Richtung des Sauerstoffatoms. Beachten Sie, dass die Summe der beiden μO-H 3D (1.5+1.5); Aber das ist nicht so. Das Wassermoment des Wassers hat einen experimentellen Wert von 1.85d. Hier ist die Wirkung des engen Winkels von 105º zwischen den H-O-H-Verbindungen.
Es kann Ihnen dienen: Labor -Thermometer: Eigenschaften, wofür es, für die Verwendung, BeispieleMethanol
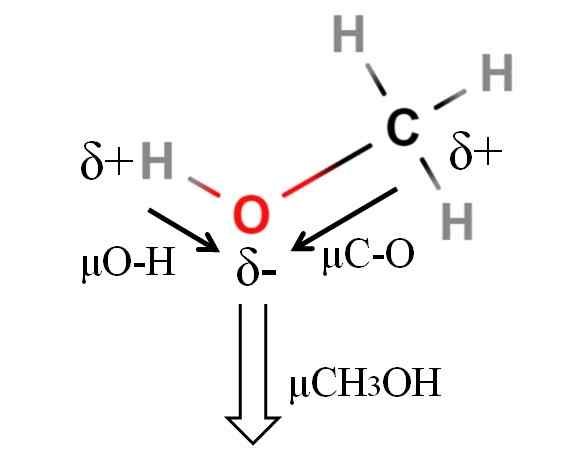 Dipoar -Moment eines Methanolmoleküls. Quelle: Gabriel Bolívar.
Dipoar -Moment eines Methanolmoleküls. Quelle: Gabriel Bolívar. Das Dipolmoment von Methanol ist 1.69d. Ist weniger als Wasser. Daher haben Atommassen im Dipolmoment nicht zu viel Einfluss; Aber seine atomaren Radios. Im Fall von Methanol können wir nicht bestätigen, dass Ihre H-O-Verbindung eine μ entspricht 1 hat 1.5 d; Da sind molekulare Umgebungen in CHO unterschiedlich3Oh und h2ENTWEDER.
Aus diesem Grund müssten wir die Länge des H-O-Verbindungsverbinds im Methanol messen, um μO-H zu berechnen. Was bestätigt werden kann, ist, dass μO-H größer als μC-O ist.
Methanol wird als eines der polarsten Lösungsmittel katalogisiert, die zusammen mit Wasser und Ammoniak gefunden werden können.
Ammoniak
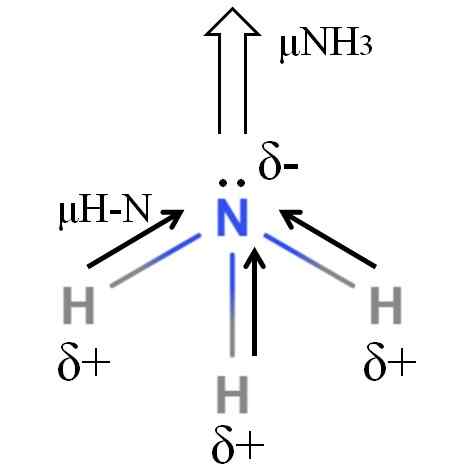 Dipoar -Moment eines Ammoniakmoleküls. Quelle: Gabriel Bolívar.
Dipoar -Moment eines Ammoniakmoleküls. Quelle: Gabriel Bolívar. H-N-Bindungen sind ziemlich polar, so dass Stickstoff nach seiner größeren Elektronegativität Elektronen zu sich selbst anzieht (überlegenes Bild). Darüber hinaus haben wir bei ihm ein paar ausgepeilte Elektronen, die ihre negativen Lasten in die δ -Region beitragen-. Daher dominieren elektrische Ladungen im Ammoniakstickstoffatom.
Das Ammoniak hat ein Dipolmoment von 1.42d, weniger als das von Methanol. Wenn sowohl das Ammoniak als auch das Methanol in Entwürfe umgewandelt werden könnten, ist ersichtlich, dass der Entwurf des Methanols im Vergleich zum Entwurf des Ammoniaks stärker definierte Pole hat.
Ethanol
Im Fall von Ethanol, Cho3CH2Oh, Ihr Dipolmoment ist dem von Methanol sehr nahe, aber es hat tendenziell niedrigere Werte. Mit mehr Kohlenstoffatomen, die die Δ+-Reiche bestehen, beginnt das Sauerstoffatom, das Δ- darstellt, ein wenig von seiner "relativen negativen Intensität" zu verlieren.
Kann Ihnen dienen: Dimethylamin ((CH3) 2NH): Struktur, Eigenschaften, Verwendungen, RisikenKohlendioxid
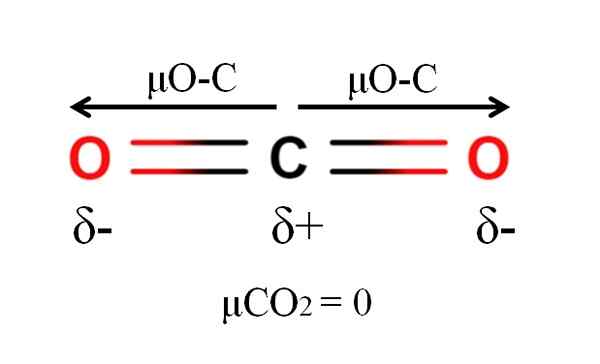 Dipoar -Moment eines Kohlendioxidmoleküls. Quelle: Gabriel Bolívar.
Dipoar -Moment eines Kohlendioxidmoleküls. Quelle: Gabriel Bolívar. Kohlendioxid hat zwei polare Bindungen, C = O, mit ihren jeweiligen Dipolmomenten μO-C. Wie im überlegenen Bild zu sehen ist, ist die lineare Geometrie des CO jedoch2 lässt die zwei μO-C gegenseitig abbrechen, auch wenn der Kohlenstoff eine positive teilweise Belastung und die negativ.
Aus diesem Grund ist Kohlendioxid ein apolares Molekül, weil μCO2 hat einen Wert von 0d.
Methan
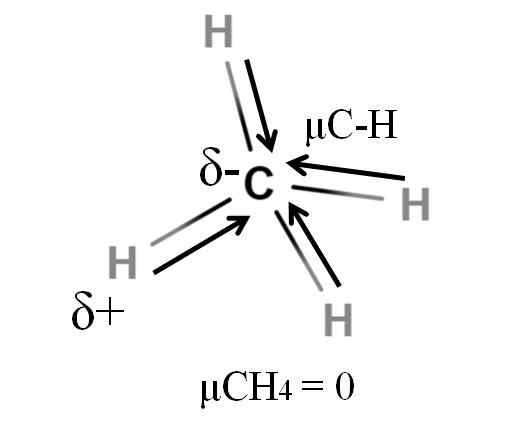 Dipolarmoment für ein Methanmolekül. Quelle: Gabriel Bolívar.
Dipolarmoment für ein Methanmolekül. Quelle: Gabriel Bolívar. Sowohl Methan als auch Kohlendioxid haben etwas gemeinsam: Sie sind hochsymmetrische Moleküle. Im Allgemeinen wird ein molekuläreres symmetrischeres Molekül, desto weniger sein Dipolmoment sein wird.
Wenn wir das Molekül von Cho sehen4, Die C-H-Bindungen sind polar und die Elektronen sind auf das Kohlenstoffatom gerichtet, weil sie etwas elektronegativer sind. Es könnte angenommen werden, dass Kohlenstoff eine sehr negative δ -Region sein müsste; als Entwurf mit seinem intensiven roten Zentrum und seinen bläulichen Enden.
Wenn jedoch die Cho geteilt ist4 In zwei Himmel2ENTWEDER. Somit wird das Dipolmoment, das aus der Zugabe dieser beiden μC-H resultiert, mit dem der anderen Hälfte aufgehoben. Und damit μch4 hat einen Wert von 0d.
Verweise
- Whitten, Davis, Peck & Stanley. (2008). Chemie. (8. Aufl.). Cengage Lernen.
- Walter J. Moore. (1963). Physikalische Chemie. In der chemischen Kinetik. Vierte Ausgabe, Longmans.
- Iran. Levine. (2009). Prinzipien der Physikochemie. Sechste Ausgabe, Seite 479-540. Mc Graw Hill.
- Helmestine, Anne Marie, ph.D. (29. Januar 2020). Dipol -Moment -Definition. Erholt von: thoughtco.com
- Blaber Mike. (29. September 2019). Dipolmomente. Chemistry Librettexts. Erholt von: Chem.Librettexts.Org
- Larita Williams. (2020). Dipolmoment: Definition, Gleichung und Beispiel. Lernen. Erholt von: Studium.com
- Wikipedia. (2020). Bond -Dipolmoment. Abgerufen von: in.Wikipedia.Org
- « Gaslicht, wie man es erfasst und 5 Tipps, um es zu vermeiden
- Onomatopoeia -Eigenschaften, Funktionen, Typen, Beispiele »

