Algebraische Ausgleichsmethode (mit Beispielen)

- 4942
- 432
- Luca Holdt
Er Algebraische Gleichgewichtsmethode Es wird in der Chemie verwendet, um der Anzahl der Atome auf beiden Seiten einer chemischen Reaktion zu entsprechen. Eine korrekt geschriebene chemische Reaktion muss die Formeln aller Reagenzien auf der linken Seite und den Produkten, auch mit ihren Formeln, auf der rechten Seite haben.
Wenn Sie jedoch eine Reaktion haben, entspricht die Anzahl der Atome in den Formeln der Reagenzien der der jeweiligen Atome in den Formeln der Produkte nicht immer nicht immer.
 Abbildung 1. Die algebraische Ausgleichsmethode ist ein einfaches Werkzeug, um chemische Gleichungen auszugleichen. Quelle: f. Zapata.
Abbildung 1. Die algebraische Ausgleichsmethode ist ein einfaches Werkzeug, um chemische Gleichungen auszugleichen. Quelle: f. Zapata. Der Teig ist jedoch erhalten. Lassen Sie uns beispielsweise die folgende Reaktion sehen:
Kcl3 → kcl + o2
Diese Gleichung verfügt. Bei sorgfältiger Beobachtung stellen wir jedoch fest, dass es im Chloratmolekül 3 Sauerstoffatome gibt, während sich rechts nur ein Gas -Sauerstoffmolekül mit 2 Atomen befindet.
Was dann getan wird, ist, sich mit einem numerischen Koeffizienten zum Reagenz der linken zu vermehren, so dass die Anzahl der Atome aller teilnehmenden Elemente vor und nach der Reaktion gleich ist.
Aber ... was ist der Wert dieses Koeffizienten??
[TOC]
Möglichkeiten, Gleichungen auszugleichen
In der vorherigen Gleichung ist es leicht, die entsprechenden Koeffizienten durch Inspektion zu bestimmen. Wenn wir uns links mit 2 multiplizieren, haben wir 2 Atome von k, 2 von CL und 6 von o.
Rechts multiplizieren wir das Kaliumchlorid mit 2 und O2 um 3:
2 kclo3 → 2kcl + 3o2
Und jetzt können wir sehen, dass die Buchhaltung auf beiden Seiten des Pfeils korrekt ist und die Reaktion ausgeglichen war. Beachten Sie, dass andere numerische Werte ebenfalls zu einer ausgewogenen Gleichung führen können, z. B.:
Kann Ihnen dienen: Borsäure: Chemische Struktur, Eigenschaften, Vorbereitung, verwendet4 kclo3 → 4kcl + 6o2
Die Menge der gesamten Mindestzahlen, die der Anzahl der Atome auf beiden Seiten entsprechen, sollte jedoch immer gesucht werden.
Die Zahlen, die jede Formel multiplizieren, werden genannt Koeffizienten. Es ist sehr wichtig zu beachten.
Es können auch keine Koeffizienten in die Mitte der Formel jeder Verbindung eingeführt werden, da sie sie verändern würde.
Einfache Gleichungen wie Beispiel können durch Inspektion oder Punktzahl ausgeglichen werden. Für diejenigen, die etwas komplexer sind.
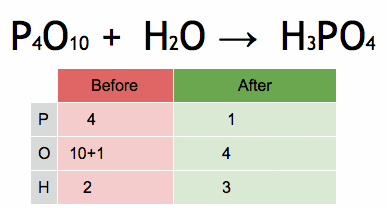 Figur 2. Animation, die das Ausgleich einer chemischen Gleichung zeigt, um Phosphorsäure zu erhalten. Quelle: Wikimedia Commons. Epert/CC BY-SA (https: // creativeCommons.Org/lizenzen/by-sa/4.0)
Figur 2. Animation, die das Ausgleich einer chemischen Gleichung zeigt, um Phosphorsäure zu erhalten. Quelle: Wikimedia Commons. Epert/CC BY-SA (https: // creativeCommons.Org/lizenzen/by-sa/4.0) Schritte zum algebraischen Gleichgewicht einer chemischen Gleichung ausgleichen
Schritt 1
-Zuweisen jedem Molekül einen beliebigen Koeffizienten, der durch einen Buchstaben symbolisiert wird. Texte A, B, C, D .. ., nach Bedarf.
Wichtig: Erinnern Sie sich daran, dass nur ein Koeffizient von Molekül verwendet wird und niemals in die Mitte durchsetzt wird. Er wird immer links platziert.
Schritt 2
-Machen Sie eine Liste jedes teilnehmenden Elements.
Schritt 3
-Platzieren Sie den Koeffizienten oder Koeffizienten, die jeder Verbindung nach links zugeordnet sind. Wenn es ein Index gibt, multiplizieren sie den Koeffizienten, um die Gesamtzahl der Atome zu ermitteln.
Und wenn in mehr als einem Molekül ein Element gefunden wird, werden die auf jeder Seite vorhandenen Atome zugesetzt. Auf diese Weise die Teilgleichungen von jedem Element.
Schritt 4
-Einer der Koeffizienten wird ein numerischer Wert zugeordnet. Normalerweise ist dieser numerische Wert 1 und wird dem Brief zugeordnet, der mehrmals erscheint. Dies erreicht eine einfache Gleichung, die als Ausgangspunkt dient, um die anderen Koeffizienten zu finden.
Kann Ihnen dienen: VerdünnungsfaktorSchritt 5
-Bestimmen Sie den Wert des folgenden Koeffizienten durch einfache Arithmetik und ersetzen Sie seinen Wert in einer anderen Gleichung, um eine neue zu erhöhen.
Schritt 6
-Wiederholen Sie den vorherigen Schritt, um Werte zu ersetzen und eine neue Gleichung zu erstellen, bis Sie alle Koeffizienten finden.
Schritt 7
-Ersetzen Sie so bestimmte Werte. Wenn diese Werte ganz sind, muss überprüft werden, ob die Gleichung ausgeglichen war. Wenn sie nicht ganz waren, wird es mit dem minimalen gemeinsamen Vielfachen der Nenner multipliziert und der Restbetrag wird überprüft.
Dann visualisieren wir die Anwendung dieser Schritte bei der Auflösung einiger Beispiele.
Beispiele gelöst
Beispiel 1
Balancieren Sie die folgende Reaktion bei Bedarf durch die algebraische Methode:
N2ENTWEDER5 → n2ENTWEDER4 + ENTWEDER2
Lösung
Wir stellen fest, dass die Reaktion nicht ausgeglichen ist, denn obwohl es auf beiden Seiten 2 Stickstoffatome gibt, sind die Mengen links und rechts unterschiedlich.
Dann müssen wir die im vorherigen Abschnitt beschriebenen Schritte befolgen:
-Wir schreiben die Gleichung erneut und multiplizieren Sie jedes Molekül mit einem anderen Koeffizienten. Kleinbuchstaben werden ausgewählt, damit sie nicht mit den Elementen verwechselt werden:
Aën2ENTWEDER5 → Bún2ENTWEDER4 + Cúo2
-Jetzt listen wir jedes Element auf und entsprechen den Mengen dieses Elements nach links und rechts. Dies sind die Teilgleichungen für jedes Element:
- Aën2 = Bún2
- Aëo5 = Boge4 + Cúo2
-Multiplizieren Sie den Koeffizienten und das Index. Aus Gleichung 1 bekommen wir:
2a = 2b
-Von Gleichung 2 haben 5 Sauerstoffatome nach links, während rechts es gibt 4b Und 2 c:
5a = 4b + 2c
-Auf diese Weise weisen wir den Koeffizienten A Wert 1 zu:
A = 1
Diese Wahl ist willkürlich, sie könnte auch zuerst ausgewählt werden B = 1.
-Diese Werte werden in Gleichung 2 ersetzt, um den Wert von C zu bestimmen:
Es kann Ihnen dienen: CUPRIC OXID (CUO)5 = 4 + 2c
2c = 5-4 = 1
C = ½
-Wir ersetzen die Koeffizienten in der ursprünglichen Gleichung, die 1 ist nicht erforderlich, um sie explizit zu schreiben:
N2ENTWEDER5 → n2ENTWEDER4 + ½ o2
-Da es vorzuziehen ist, dass die Koeffizienten ganz sind, wird die gesamte Gleichung mit dem minimalen gemeinsamen Vielfachen der Nenner multipliziert, die 2 und 1 sind:
M.C.M. (1.2) = 2
Wenn Sie dann nach links und rechts mit 2 multiplizieren, wird es erhalten:
2n2ENTWEDER5 → 2n2ENTWEDER4 + ENTWEDER2
Und wir zählen die Anzahl der Atome auf beiden Seiten, um das Gleichgewicht zu überprüfen:
- N links: 4
- Oder links: 10
- N rechts: 4
- Oder rechts: 8 + 2 = 10
Beispiel 2
Gleiche die folgende chemische Reaktion:
Nahco3 → na2CO3 + H2Oder + co2
Lösung
Wir multiplizieren jedes Molekül mit einem anderen Koeffizienten:
Aoge Nahco3 → Búna2CO3 + Cúh2O + dechen2
Dann schlagen wir die Bilanzierung jedes Elements rechts und links vom Pfeil vor. Es gibt insgesamt 4 Elemente in der Reaktion: Natrium na; Wasserstoff H; Autowagen und Sauerstoff oder alle müssen gezählt werden:
- AX = boge2
- a · h = cúh2
- Aëc = boge + dechen
- Aëo3 = Boge3+Cëo+deichen2
Nach jedem Restbetrag werden folgende Gleichungen erhalten:
1) a = 2b
2) a = 2c
3) a = b + d
4) a = 3b + c + 2d
Der wiederholte Koeffizient ist Zu, Daher weisen wir den Wert 1 zu:
A = 1
So:
1) a = 2b ⇒ b = ½
2) a = 2c ⇒ c = ½
3) a = b + d ⇒ d = a - b = 1 - ½ = ½
Wir ersetzen die Koeffizienten in der Gleichung:
Nahco3 → ½. N / A2CO3 + ½. H2O + ½.CO2
Wir multiplizieren auf beiden Seiten des Pfeils mit 2, da es der einzige vorhandene Nenner ist, um den Bruch zu beseitigen:
2nahco3 → na2CO3 + H2Oder + co2
Wir zählen die Anzahl der links vorhandenen Atome: 2 Atome von Na, H und C und 6 von O. Der Leser kann überprüfen, ob jeder von ihnen auch rechts in denselben Mengen vorhanden ist.
Verweise
- Atkins, p. Prinzipien der Chemie: Die Wege der Entdeckung. Pan -American Medical Editorial. 3. Auflage.
- Briceño, j. USB -Chemiehandbuch. Erholt von: Gecousb.com.gehen.
- Chang, R. 2013. Chemie. 11va. Auflage. MC Graw Hill Education.
- Gelöste Übungen. Algebraischer Ausgleich. Abgerufen von: Suellted -Übungen.CO.
- Simoza, l. Ausgleich von chemischen Gleichungen. Erholt von: Guao.Org.
- « Tote Ladungsmerkmale, Berechnung, Beispiele
- Inka -Architekturmerkmale und herausragende Konstruktionen »

