Bariumnitrat -chemische Struktur, Verwendungen, Eigenschaften

- 4543
- 594
- René Riediger
Er Bariumnitrat Es ist ein Salz, das aus einem Bariumatom (BA) und einem Nitration (nein3). Es wird bei Raumtemperatur als weißer kristalliner Feststoff vorgestellt und existiert in der Natur als sehr seltener Mineral, der als Nitrobarita bekannt ist. Seine Eigenschaften machen es zu einer giftigen Verbindung, die sorgfältig verwaltet werden muss.
Tatsächlich hat diese Verbindung in der Militärindustrie mehrere Verwendungszwecke, da sie unter anderem mit anderen chemischen Substanzen in Verbindung gebracht werden und zu explosiven und brandnäckigen Formulierungen hinzugefügt werden kann.
 Bariumnitrat -Aussehen. Quelle: w. Oelen/CC BY-SA (https: // creativecommons.Org/lizenzen/by-sa/3.0)
Bariumnitrat -Aussehen. Quelle: w. Oelen/CC BY-SA (https: // creativecommons.Org/lizenzen/by-sa/3.0) [TOC]
Formel
Bariumnitrat, auch Bariumdyitrat genannt, hat die chemische Formel BA (nein3)2, und wird normalerweise durch zwei Methoden hergestellt.
Das erste davon beinhaltet die Auflösung kleiner Barium -Carbonatstücke (Bacchus3) In einem mittelsäurigen Medium (hno3, eine hochkarrosive Mineralsäure), die Eisenverunreinigungen ausfällt, und dann wird dieses Gemisch gefiltert, verdampft und kristallisiert.
Die zweite Methode erfolgt durch die Kombination von Bariumchlorid (BACL2, Eines der Bariumsalze von größerer Löslichkeit im Wasser) mit einer vorgeheizten Lösung von Natriumnitrat. Dies erzeugt eine Reaktion, die zur Trennung von Gemischbariumnitratkristallen führt.
Chemische Struktur von Bariumnitrat
Dieses Salz zeigt Eigenschaften einer kubischen kristallinen Struktur oder wasserfreien Oktaedros.
Seine chemische Struktur ist wie folgt:
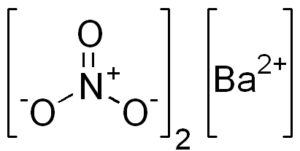
Dissoziation
Bei hohen Temperaturen (592 ° C) zersetzt Bariumnitrat zur Bildung von Bariumoxid (BAO), Stickstoffdioxid (NO2) und Sauerstoff (oder2), Gemäß der folgenden chemischen Reaktion:
Kann Ihnen dienen: Beryl Hydroxid (BE (OH) 2)2ba (Nr3)2 + Hitze → 2bao + 4no2 +ENTWEDER2
In Medien mit hohen Stickoxidkonzentrationen (NO) erzeugt die Zersetzung von Bariumnitrat eine Verbindung namens Bariumnitrit (BA (NO)2)2), Gemäß der folgenden Gleichung:
Badezimmer3)2 + 2no → ba (nein2)2 + 22
Reaktionen mit löslichem Metall oder Schwefelsäuresulfaten (H)2SW4) Bariumsulfat erzeugen (Baso4). Die überwiegende Mehrheit der unlöslichen Bariumsalze wie Carbonat (Bacchus3), Oxalat (BAC2ENTWEDER4) oder Metallphosphat (BA3(PO4)2), werden durch ähnliche Doppel -Zersetzungsreaktionen ausgefällt.
Bariumnitrat verwendet
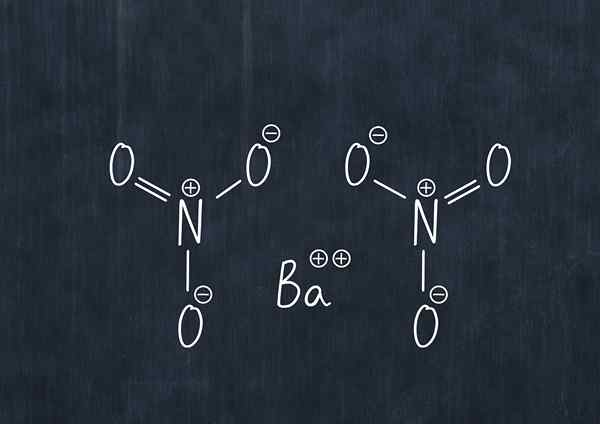 Chemische Formel von Bariumnitrat
Chemische Formel von Bariumnitrat Diese Staubsubstanz ist ein Oxidationsmittel und reagiert signifikant mit gemeinsamen Reduktionsmitteln.
Wenn dieses Salz mit anderen Metallen wie Aluminium oder Zink in seinen fein geteilten Formen oder mit Legierungen wie Aluminium-Magn0esio gemischt wird, schaltet es die Wirkung ein und nutzt sie aus. Aus diesem Grund gilt Bariumnitrat als hervorragender Bestandteil von militärischen Waffen und Sprengstoff.
Zusammen mit Trinitrotoluol (kommerziell als TNT bekannt, oder c6H2(NEIN2)3CH3) und ein Bindemittel (regelmäßig Paraffin -Wachs) bildet dieses Salz eine Verbindung namens Baratol, die explosive Eigenschaften aufweist. Die hohe Dichte von Bariumnitrat bewirkt, dass das Baratol auch eine größere Dichte erbringt.
Bariumnitrat verbindet auch Aluminiumstaub, eine Formel, die zur Bildung blinkender Schießpulver führt, die hauptsächlich in Feuerwerk und Theaterpyrotechnik verwendet wird.
Diese Blitze haben auch Verwendungszwecke bei der Herstellung von Fackeln (wie Antimilemessungen von Flugzeugen) und in betäubten Granaten gesehen. Darüber hinaus ist diese Substanz sehr explosiv.
Es kann Ihnen dienen: Natriumcyanid (NACN): Struktur, Eigenschaften, Risiken, verwendetDieses Salz wird mit der Reaktantenmischung kombiniert, die als Thermit bezeichnet wird, um eine Variation dieses sogenannten Termins zu bilden, der für kurze Zeit kurze und sehr starke Blitze mit hohen Temperaturen in kleinen Bereichen erzeugt.
Der Terate-tH3 ist ein Termin, der eine 29 % ige Zusammensetzung durch Bariumnitratgewicht enthält, die dazu beiträgt, den thermischen Effekt zu erhöhen, Flammen zu erzeugen und die Zündtemperatur des Termins erheblich zu verringern.
Theroots werden normalerweise bei der Herstellung von Brandgranaten verwendet und haben die Funktion, Militärpanzerrüstung und Strukturen zu zerstören.
Darüber hinaus war Bariumnitrat einer der am häufigsten verwendeten Zutaten bei der Herstellung von Brandanklagen, die die Briten in ihren Kriegsflugzeugen während des Zweiten Weltkriegs verwendeten, die mit Brandmunition bewaffnet waren, die dazu dienten, feindliche Flugzeuge zu zerstören.
Schließlich hat dieses Salz im Herstellungsprozess von Bariumoxid, in der thermionischen Ventilindustrie und, wie bereits gesagt, bei der Schaffung von Pyrotechnikern, insbesondere der von grünen Farben.
Physikalische und chemische Eigenschaften
 Bario Bai Nitrato (NO3) 2
Bario Bai Nitrato (NO3) 2 Salz wird als weißer, hygroskopischer und toilette fester.
Es hat eine Molmasse von 261.337 g/mol, eine Dichte von 3,24 g/cm3 und ein Fusionspunkt von 592 ºC. Nach dem Erreichen des Siedepunkts bricht es zusammen, wie oben gesagt wurde. Bei Raumtemperatur hat es eine Wasserlöslichkeit von 10,5 g/100 ml.
Es wird als stabil angesehen, ist aber ein starkes Oxidationsmittel und muss von brennbaren Materialien weg sein, um Feuer zu vermeiden. Es hat eine Wasserempfindlichkeit und sollte nicht mit Säuren oder wasserfreiem gemischt werden.
Kann Ihnen dienen: Adsorptionsisothermen: Konzept, Typen, BeispieleIn hohen Konzentrationen (z. B. Behälter) müssen aus Substanzen isoliert werden, die es reagieren können, da es heftig ausnutzen kann.
Wie jede andere lösliche Verbindung von Barium ist es eine giftige Substanz für Tiere und Menschen.
Es sollte nicht eingeatmet oder konsumiert werden, da die Symptome der Vergiftung (insbesondere der Verhärten der Gesichtsmuskeln), Erbrechen, Durchfall, Bauchschmerzen, Muskelzittern, Angst, Schwäche, Atemnot, Herzunregelmäßigkeit und Anfälle und Anfälle.
Der Tod kann nach einer Vergiftung mit dieser Substanz auftreten, einige Stunden oder einige Tage nach der Präsentation.
Die Inhalation von Bariumnitrat erzeugt Reizungen in der Atemschleimhaut, und in beiden Modi der Vergiftung müssen Sulfatsalzlösungen vorbereitet sein, um Erste Hilfe auf die Betroffenen anzuwenden.
Im Falle von Verschüttungen muss es aus brennbaren Substanzen und Materialien isoliert werden, und bei Brand sollten Sie niemals mit trockenen Chemikalien oder Schäumen in Kontakt kommen. Das Gebiet muss mit Wasser überflutet werden, wenn das Feuer größer ist.
Verweise
- Mabus. (S.F.). Sciencemadness. Aus Sciencemadness erhalten.Org
- United States Bomb TH3-M50A3. (S.F.). Aus Munitionspagnen erhalten.com
- Cameo -Chemikalien. (S.F.). Von Camechemicals erhalten.NOAA.Regierung
- Chemspider. (S.F.). Aus Chemspider erhalten.com
- « Soj produktive Schaltungsstadien und Eigenschaften
- Dynamik eines Teilchensystems Beispiele, Übungen »

