Calciumnitrat (CA (NO3) 2)

- 3015
- 875
- Joy Hort
Er Kalziumnitrat Es ist ein tertiäres anorganisches Salz, dessen chemische Formel CA ist (nein3)2. Aus seiner Formel ist bekannt, dass sein Feststoff aus CA -Ionen besteht2+ und nicht3- In einem 1: 2 -Verhältnis. Daher ist es eine Verbindung einer rein ionischen Natur.
Eine seiner Eigenschaften ist sein oxidierender Charakter, der dem Nitratanion nach. Es ist kein Kraftstoff, das heißt, es brennt bei hohen Temperaturen nicht. Es ist nicht fuelor, es ist ein sicherer Feststoff, um es ohne große Sorgfalt zu manipulieren. Es kann jedoch die Zündung brennbarer Materialien beschleunigen.
 Solide Calciumnitrat. Quelle: Ondřej Manggl [Public Domain] aus Wikimedia Commons
Solide Calciumnitrat. Quelle: Ondřej Manggl [Public Domain] aus Wikimedia Commons Sein Aussehen besteht aus körnigem Feststoff, das eine hell weiße oder graue Farbe aufweist (überlegenes Bild). Es kann wasserfrei oder Tetrahydrat sein, CA (nein3)2· 4h2ENTWEDER. Es ist sehr löslich in Wasser, Methanol und Aceton.
Calciumnitrat wurde häufig als Dünger verwendet, da es sich leicht im feuchten Boden bewegt und von Pflanzenwurzeln schnell absorbiert wird. Liefert zwei wichtige Elemente für die Ernährung und das Wachstum von Pflanzen: Stickstoff und Kalzium.
Stickstoff ist eines der drei wesentlichen Elemente für die Entwicklung von Pflanzen (N, P und K), es ist wesentlich für die Proteinsynthese, es ist wesentlich. In der Zwischenzeit ist Kalzium notwendig, um die Struktur der Zellwand der Pflanzen aufrechtzuerhalten. Aus diesem Grund die CA (nein3)2 Gärten sind sehr bestimmt.
Andererseits hat dieses Salz giftige Wirkungen, insbesondere durch direkten Kontakt mit Haut und Augen sowie in Einatmen seines Staubes. Außerdem kann es durch Erwärmung abgebaut werden.
Calciumnitratstruktur
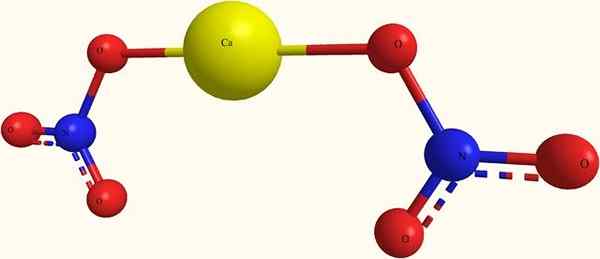 Calciumnitrationen. Quelle: я.Hardnox bei Ru.Wikipedia [Public Domain] aus Wikimedia Commons
Calciumnitrationen. Quelle: я.Hardnox bei Ru.Wikipedia [Public Domain] aus Wikimedia Commons Im oberen Bild die Struktur der CA (nein3)2 In einem Kugeln und Bars Modell. Hier gibt es jedoch einen Defekt: Die Existenz von kovalenten Bindungen von Ca-O wird angenommen, was seinem ionischen Charakter widerspricht. Wenn Sie dies klären, sind die Wechselwirkungen wirklich vom elektrostatischen Typ.
Das Kation ca2+ Es ist von zwei Anionen umgeben, nein3- Nach seinen Proportionen im Glas. Stickstoff in Form von Nitrat in der kristallinen Struktur überwiegt.
Die Ionen werden so gruppiert, dass sie eine Konfiguration herstellen, deren minimaler Ausdruck die einheitliche Zelle ist. die für wasserfreies Salz kubisch ist. Das heißt, aus Würfel, die den 1: 2 -Verhältnis für diese Ionen enthalten, wird das gesamte Glas reproduziert.
Kann Ihnen dienen: Zinn: Struktur, Eigenschaften, erhalten, verwendet, verwendetAndererseits das Tetrahydratsalz, CA (nein3)2· 4h2Oder es hat vier Wassermoleküle für jeden Satz3- AC2+ NEIN3-. Dies modifiziert die kristalline Struktur und verformt sie in einer einheitlichen monoklinen Zelle.
Daher sind Kristalle für Salze, wasserfrei und Tetrahydrat, unterschiedlich; Unterschiede, die in ihren physikalischen Eigenschaften bestimmt werden können, z. B. Fusionspunkte.
Physikalische und chemische Eigenschaften
Chemische Namen
-Kalziumnitrat
-Kalziumdinitrate
-Nitrocalcita
-Norweger Salitre und Limesaltpetro.
Molekularformel
Tülle3)2 oder können2ENTWEDER6
Molekulargewicht
Anhidro 164.088 g/mol und Tetrahydrat 236,15 g/mol. Beachten Sie die Wirkung von Wasser auf das Molekulargewicht und können nicht verachtet werden, wenn es die jeweiligen schweren macht.
Aussehen
Festes oder hellgraues Granulat. Kubische weiße Kristalle oder köstliche Granulate; Das heißt, sie absorbieren Feuchtigkeit bis zu dem Punkt, dass sie das Produkt ihrer hohen Löslichkeit auflösen.
Siedepunkt
Die wasserfreie Form zersetzt sich durch Erhitzen bei einer Temperatur, die die Bestimmung ihres Siedepunkts verhindert; Während die Tetrahydrat -Salzform einen Siedepunkt von 270 ºF, 405 K aufweist, hat ein Siedepunkt von 132 ° C).
Schmelzpunkt
-Anhydra Form: 561 ºC bis 760 mmHg (1042 ºF, 834 K).
-Tetrahydratform: 42,7 ºC (109 ºF, 316 K).
Dies zeigt, wie Wassermoleküle die elektrostatischen Wechselwirkungen zwischen dem CA stören2+ und nicht3- Innerhalb der Kristalle; Und folglich schmilzt der Feststoff bei einer viel niedrigeren Temperatur.
Wasserlöslichkeit
-Anhydra Form: 1212 g/l bei 20 ºC.
-Tetrahydratform: 1290 g/l bei 20 ºC.
Wasser in Kristallen erhöht kaum die Salzlöslichkeit.
Löslichkeit in organischen Lösungsmitteln
-In Ethanol 51,42 g/100 g bei 20 ºC.
-In Methanol 134 g/100 g bei 10 ºC.
-Im Aceton 168 g/100 g bei 20 ºC.
Säure (PKA)
6.0
Dichte
2,5 g/cm3 bei 25 ºC (Tetrahydrat).
Zersetzung
Wenn Calciumnitrat auf Gläubige erhitzt wird, zersetzt es sich in Calciumoxid, Stickoxid und Sauerstoff.
Reaktivprofil
Es ist ein stark oxidierendes Mittel, aber es ist kein Kraftstoff. Beschleunigt die Zündung brennbarer Materialien. Die Calciumnitrat -Aufteilung in feine Partikel erleichtert seine Explosion, wenn die Verbindung längeres Feuer ausgesetzt ist.
Kann Ihnen dienen: Nicht -ferrous Legierungen: Struktur, Eigenschaften, Verwendungen, BeispieleGemische mit Alkylester werden explosiv, indem Alkylnitratester verursacht werden. Die Kombination von Calciumnitrat mit Phosphor, Zinnchlorid (II) oder einem anderen Reduktionsmittel kann explosionsartig reagieren.
Anwendungen
Landwirtschaft
Es wird in Pflanzen als Quelle für Stickstoff und Kalzium verwendet. Calciumnitrat ist im Wasser sehr löslich und leicht von den Wurzeln der Pflanzen absorbiert. Darüber hinaus säutieren es keine Böden, da ihre Ionen nicht wesentlich hydrolyisieren können.
Seine Mischung sollte mit Düngemitteln, die Phosphor oder Sulfat enthalten, vermieden werden, um die Bildung von unlöslichen Salzen zu vermeiden. Nach Ihrer Hygroskopizität muss sie in einer trockenen und frischen Umgebung aufbewahrt werden.
Seine Verwendung hat einen Vorteil gegenüber der Verwendung von Ammoniumnitrat als Dünger. Während die letztere Verbindung Stickstoff in Pflanzen bringt, stört die Calciumabsorption, was einen Calciummangel in Pflanzen erzeugen könnte.
Kalzium trägt zur Aufrechterhaltung der Zellwandstruktur der Anlage bei. In Gegenwart eines Kalziummangels zeigen die Gewebe in der Pflanzenbildung, wie die Spitzen der Wurzeln, die jungen Blätter und die Spitzen der Ausbrüche, oft verzerrtes Wachstum.
Abnahme des Ammoniums
Calciumnitrat reduziert die Akkumulation von flüchtigen Fettsäuren und phenolischen phytotoxischen Verbindungen.
Darüber hinaus gibt es einen Calciumnitrat -Trend, um die Ammoniumkonzentration im Boden zu verringern, was die Wasserstoffdämpfungskapazität erhöht.
Beton
Calciumnitrat wird verwendet, um die konkrete Einstellungszeit zu verkürzen. Dies wird durch die Erzeugung von Calciumhydroxid erzeugt, möglicherweise durch eine doppelte Verschiebungsreaktion.
Darüber hinaus induziert Calciumnitrat die Erzeugung der Eisenhydroxidverbindung, deren Schutzwirkung von Beton seine Korrosion verringert. Das heißt, dass Eisen mit den Grundkomponenten von Beton wie Calciumhydroxid selbst reagieren kann.
Calciumnitrat verringert die Einstellungszeit sowie den Widerstand des Betons, zu dem Vulkanasche zugegeben wurde. Um den Effekt des Calciumnitrataggregats auf Beton zu untersuchen, wurden die Konzentrationen von Calciumnitrat zwischen 2% und 10% erhöht.
Es kann Ihnen dienen: Molarenfraktion: Wie es berechnet wird, Beispiele, ÜbungenEine höhere Abnahme der Settungszeit wurde beobachtet, sowie eine Zunahme des Betonresistenzes mit zunehmender Calciumnitratkonzentration auf 10%.
Abwasser- oder Abfallbehandlung
Calciumnitrat wird verwendet, um schlechte Gerüche nach Abwasser zu verringern, indem Wasserstoffsulfid verringert wird. Darüber hinaus wird die organische Substanz, die anaerobe Zustände erzeugt, die das Überleben vieler biologischer Arten behindern.
Kaltkomprimierungsvorbereitung
Tetrahydrat -Calciumnitrat ist eine endotherme Verbindung, dh es hat die Fähigkeit, Wärme aus der Umgebung zu absorbieren, die sie umgibt. Dies erzeugt eine Kühlung der Körper, die mit den Behältern in Kontakt kommen, die sie enthalten.
Die Kompressen erhöhen ihre Temperatur und um sie zu regenerieren, reicht es aus, sie in einen Gefrierschrank zu legen
Latexkoagulation
Calciumnitrat wird in der Latex -Koagulationsphase verwendet. Es ist Teil der Immersionslösung, und wenn es in Kontakt mit der Lösung kommt, die der Latex enthält, bricht es seine Stabilisierung und verursacht seine Koagulation.
Wärmeübertragung und Lagerung
Die binäre Mischung aus geschmolzenen Nitratensalze, einschließlich Kalzium mit anderen Nitraten.
Anwendungsformen
-Mit dem Boden gemischte Kalziumnitrat wird auf eine Konzentration von 1,59 kg für 30,48 m angewendet2, mit angemessener Bewässerung. Calciumnitrat wird im Wasser solubilisiert, was seine Absorption durch die Wurzeln der Pflanze ermöglicht. In Hydroponikern löst es sich in Kultivierungswasser auf.
-Spray -fallses Calciumnitrat wird auch verwendet, um die Blätter und Blüten zu sprühen. Dies ist eine wirksame Behandlung bei der Vorbeugung der Fäulnis der Tomatenblume, des Korkenflecks und des bitteren Lochs des Apfels.
-Es wird dem Betonmisch (Zement, Sand, Steine und Wasser) eine Menge Calciumnitrat (Zement, Sand, Steine und Wasser) hinzugefügt, und die Wirkung des Zugabes von IT auf die spezifischen Eigenschaften von Beton hat; wie die Festlegung von Geschwindigkeit und Widerstand.
-Calciumnitrat wird zu einer angemessenen Konzentration hinzugefügt, um schlechte Gerüche nach Abwasser oder Rest zu reduzieren, auf ein Niveau, das Gerüche für Menschen tolerierbar sind.
Verweise
- Calciumnitratspezifikationen. Erholt von: Direct2Farmer.com
- Kalziumnitrat. Erholt von: Pubchem.NCBI.NLM.NIH.Regierung

