Kupfernitrat (II)
- 1660
- 403
- Ibrahim Steuk
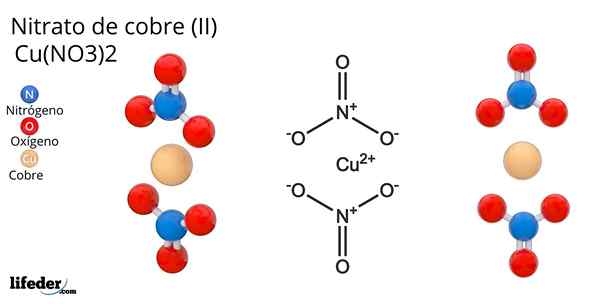
 Formel und Struktur von Kupfernitrat (II)
Formel und Struktur von Kupfernitrat (II) Er Kupfernitrat (Ii) oder Cupric -Nitrat, deren chemische Formel Cu ist (nein3)2, Es ist ein brillantes anorganisches Salz und attraktive blaugrüne Farben. Es wird im industriellen Maßstab aus der Zersetzung von Kupfermineralien, einschließlich Gerhardita und Rouaita -Mineralien, synthetisiert.
Andere praktikablere Methoden in Bezug auf Rohmaterial und gewünschte Salzmengen bestehen aus direkten Reaktionen mit Metallkupfen und seinen abgeleiteten Verbindungen. Wenn Kupfer mit einer konzentrierten Lösung von Salpetersäure (HNO) in Kontakt steht3) Es tritt eine Redoxreaktion auf.
In dieser Reaktion oxidiert Kupfer und Stickstoff wird gemäß der folgenden chemischen Gleichung reduziert:
Cu (S) + 4HNO3(conc) => cu (nein3)2(Ac) + 2h2Oder (l) + 2no2(G)
Stickstoffdioxid (Nein2) ist ein braunes und schädliches Gas; Die resultierende wässrige Lösung ist bläulich. Kupfer kann das Problem bilden (Cu+) Das kuprische Ion (Cu2+) oder das am wenigsten gewöhnliche Ion Cu3+; Das Problem wird jedoch in wässrigen Medien von vielen elektronischen, Energie- und geometrischen Faktoren nicht bevorzugt.
Das Standardreduktionspotential für CU+ (0,52 V) ist größer als für Cu2+ (0,34 V), was bedeutet, dass die Cu+ Es ist instabiler und neigt dazu, ein Elektron zu gewinnen, um Cu (s) zu werden. Diese Elektrochemie -Maßnahme erklärt, warum es keinen Cuno gibt3 als Produkt der Reaktion oder zumindest im Wasser.
[TOC]
Kupfernitrateigenschaften
 Kupfernitrat -Aussehen (ii) Triohydrat
Kupfernitrat -Aussehen (ii) Triohydrat Kupfernitrat ist Anhydrid (trocken) oder mit unterschiedlichen Wasseranteilen hydratisiert. Anhydrid ist eine blaue Flüssigkeit, aber nach Koordinierung mit Wassermolekülen - in der Lage, Wasserstoffbrücken zu bilden - kristallisiert wie Cu (nein3)2· 3h2O o cu (nein3)2· 6h2ENTWEDER. Dies sind die drei verfügbaren Salzformen auf dem Markt.
Es kann Ihnen dienen: Helmholtz freie Energie: Einheiten, wie es berechnet wird, gelöste ÜbungenDas Molekulargewicht für Trockensalz beträgt 187,6 g/mol und ergänzt diesen Wert 18 g/mol für jedes Wassermolekül, das in das Salz eingebaut ist. Seine Dichte beträgt 3,05 g/ml und nimmt durch jedes eingebaute Wassermolekül ab: 2,32 g/ml für Tri-hydratisiertes Salz und 2,07 g/ml für Hexa-Hydrated-Salz. Es hat keinen Siedepunkt, sondern unter Sublima.
Die drei Formen von Kupfernitrat sind in Wasser, Ammoniak, Dioxan und Ethanol sehr löslich. Seine Schmelzpunkte steigen als ein weiteres Molekül zum externen Koordinationsbereich von Kupfer hinzu. Auf die Fusion folgt die thermische Zersetzung von Kupfernitrat, die die schädlichen Gase von NO erzeugt2:
2 Cu (nein3)2(s) => 2 cuo (s) + 4 nein2(g)+ oder2(G)
Die obige chemische Gleichung ist für Anhydridsalz; Bei hydratisierten Salzen tritt auch Wasserdampf auf der rechten Seite der Gleichung auf.
Elektronische Konfiguration
Elektronische Konfiguration für Ion Cu2+ Es ist [ar] 3D9, Präsentation der Paramagnetismus (das Elektron im 3D -Orbital9 ist verschwunden).
Als Kupfer ist ein Übergangsmetall der vierten Periodenperiode des Periodensystems und hat zwei seiner Valencia -Elektronen pro Wirkung des HNO verloren3, Es verfügt noch über 4S- und 4P -Orbitale, um kovalente Bindungen zu bilden. Noch mehr, die Cu2+ Sie können zwei der äußersten 4D -Orbitale verwenden, um bis zu sechs Moleküle koordinieren zu können.
Die Anionen Nr3- Sie sind flach und für die Cu2+ Sie können mit ihnen koordinieren, müssen eine SP -Hybridisierung haben3D2 Dadurch können Sie eine oktaedrische Geometrie annehmen. Dies verhindert Anionen nicht3- unter ihnen "getroffen" sein.
Es kann Ihnen dienen: Kondensierte Formel: Was ist und Beispiele (Methan, Ethan, Glukose ...)Dies wird durch Cu erreicht2+, Platzieren Sie sie in eine quadratische Ebene um sich selbst. Die resultierende Konfiguration für das Atom von Cu innerhalb von Salz lautet: [AR] 3D94s24p6.
Chemische Struktur
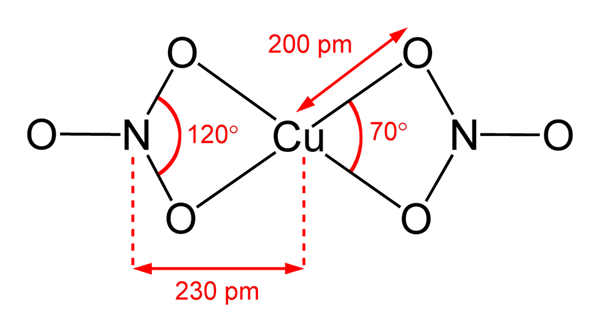 Kupfernitratstruktur (II)
Kupfernitratstruktur (II) Im überlegenen Bild wird ein isoliertes Molekül der Cu dargestellt (nein3)2 in einer Gasphase. Nitratanionen-Sauerstoffatome werden direkt mit dem Kupferzentrum (interner Koordinationsbereich) koordiniert und bilden vier Cu-O-Bindungen.
Es hat eine molekulare Geometrie der quadratischen Ebene. Die Ebene wird von den roten Kugeln in den Eckpunkten und der Kupferkugel in der Mitte gezeichnet. Die Wechselwirkungen zwischen Gasphasen sind aufgrund elektrostatischer Abstoßungen zwischen Gruppen nicht sehr schwach3-.
In fester Phase bilden die Kupferzentren jedoch Metallverbindungen -cu-cu-, wodurch polymere kupferige Ketten erzeugt werden.
Wassermoleküle können Wasserstoffbrücken mit Gruppen nicht bilden3-, und diese bieten Wasserstoffbrücken für andere Wassermoleküle und so weiter bis zu einer Wasserkugel um Cu (nein3)2.
In diesem Bereich kann es 1 bis 6 äußere Nachbarn haben; Daher ist das Salz leicht hydratisiert, um hydratisierte Tri- und Hexa -Salze zu erzeugen.
Salz wird aus einem Ion Cu gebildet2+ und zwei Ionen nein3-, Gewährung einer charakteristischen Kristallinität von ionischen Verbindungen (ortorrombisch für washrides Salz, Rhomboédica für hydratisierte Salze). Die Verbindungen haben jedoch einen größeren kovalenten Charakter.
Verwendet/Anwendungen
Für die faszinierenden Farben des Kupfernitrat.
Kann Ihnen dienen: EnthalpieFür viele Reaktionen ist es eine gute Ionenquelle, insbesondere für solche, bei denen es organische Reaktionen katalysiert. Es findet auch ähnliche Verwendungen für andere Nitrate, entweder als Fungizid, Herbizid oder als Holzkonservierungsmittel.
Ein weiterer der Haupt- und Neunutzungen ist in der Synthese von Cuo -Katalysatoren oder Materialien mit photoempfindlichen Eigenschaften.
Es wird auch als klassisch.
Risiken
- Es handelt. Es ist wichtig, den gesamten physischen Kontakt direkt mit dem Reagenz zu vermeiden.
- Es ist nicht brennbar.
- Es zersetzt sich bei hohen Temperaturen, die reizende Gase unter diesen freisetzen2.
- Im menschlichen Organismus kann es chronische Schäden an den zentralen Herz -Kreislauf- und Nervensystemen verursachen.
- Kann Reizungen im Magen -Darm -Trakt verursachen.
- Ein Nitrat zu sein, im Körper wird es Nitrit. Nitrit erhöht die Verwüstungen im Sauerstoffgehalt im Blut und im kardiovaskulären System.
Verweise
- Tag, r., & Underwood, a. Quantitative analytische Chemie (Fünfter Aufl.). Pearson Prentice Hall, P-810.
- Mel Science. (2015-2017). Mel Science. Von Mel Science geborgen: Melscience.com
- ResearchGate GmbH. (2008-2018). ResearchGate. Von ResearchGate erholt: ResearchGate.Netz
- Wissenschaftslabor. Wissenschaftslabor. Aus dem Wissenschaftslabor geborgen: Sciencelab.com
- Whitten, Davis, Peck & Stanley. (2008). Chemie (Achtes Ausgabe.). P-321. Cengage Lernen.
- Wikipedia. Wikipedia. Wikipedia erholte sich: in.Wikipedia.Org

