Magnesiumnitrat (Mg (No3) 2) Struktur, Eigenschaften, verwendet, verwendet

- 3216
- 726
- Tizian Liebich
Er Magnesiumnitrat Es ist ein anorganischer Feststoff, dessen chemische Formel Mg ist (nein3)2. Es ist eine ionische Verbindung, die durch die Vereinigung eines Magnesiumkation gebildet wird2+ und zwei Nitratanionen nein3-.
Das mg (nein3)2 Es ist ein kristalliner weißer Feststoff. Es ist sehr hygroskopisch, das heißt, es absorbiert leicht Wasser aus der Umwelt. Indem es mit der Umwelt in Kontakt bleibt, neigt es dazu, sein MG Hexahydrat zu bilden (nein3)2 •6h2ENTWEDER.
 Mg Magnesiumnitrat (Nein3)2 pulverisiert. Ondřej Manggl [Public Domain]. Quelle: Wikimedia Commons.
Mg Magnesiumnitrat (Nein3)2 pulverisiert. Ondřej Manggl [Public Domain]. Quelle: Wikimedia Commons. Magnitrathexahydrat (nein3)2 •6h2O es hat in seiner kristallinen Struktur 6 Wassermoleküle H2Oder für jedes Mg -Molekül (nein3)2. Magnesiumnitrat kommt in Höhlen und Minen in Form eines Nitromagnesit -Minerals vor.
Das mg (nein3)2 Es wird kommerziell durch Reaktion des Mg -Metallmetalls mit Salpetersäure -HNO erhalten3.
Es hat sehr unterschiedliche Verwendungen wie Landwirtschaft als Dünger, da es nahrhafte Elemente für Pflanzen wie Stickstoff (N) und Magnesium (Mg) bietet.
Es wird in der Feuerwerksindustrie oder in der Pyrotechnik und in der Erlangung konzentrierter Salpetersäure verwendet. Es wird in der chemischen Analyse, in Physikexperimenten sowie in medizinischen und wissenschaftlichen Studien verwendet.
[TOC]
Struktur
Anhydro -Magnesiumnitrat wird durch ein Magnesio -Mg -Kation gebildet2+ und zwei Nitratanionen nein3-.
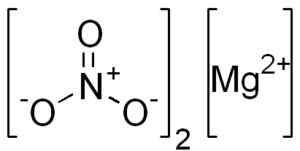 Mg -Struktur (nein3)2. Edgar181 [Public Domain]. Quelle: Wikimedia Commons.
Mg -Struktur (nein3)2. Edgar181 [Public Domain]. Quelle: Wikimedia Commons. Das Magnesio -Mg -Ion2+ Es hat elektronische Konfiguration: 1s2, 2s2 2 p6, 3s0, Nun, die beiden Elektronen der äußersten Schicht (3s) haben ergeben. Diese Konformation ist sehr stabil.
Die Ionnr3- Es hat eine flache und symmetrische Struktur.
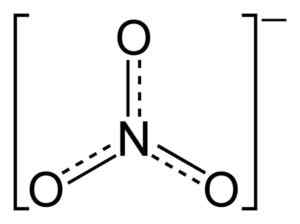 Flache Nitrat -Ionenstruktur Nr3-. Die gepunkteten Linien geben die gerechte Verteilung der Elektronen zwischen den drei N-O-Bindungen an. Benjah-BMM27 [Public Domain]. Quelle: Wikimedia Commons.
Flache Nitrat -Ionenstruktur Nr3-. Die gepunkteten Linien geben die gerechte Verteilung der Elektronen zwischen den drei N-O-Bindungen an. Benjah-BMM27 [Public Domain]. Quelle: Wikimedia Commons. In der Struktur von nein3- Die negative Belastung wird kontinuierlich zwischen den drei Sauerstoffatomen verteilt.
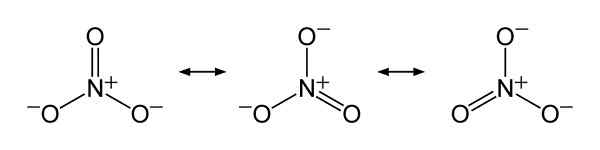 Nitrat -Ionenresonanzstrukturen Nr3-, Um die gerechte Verteilung der negativen Belastung zwischen den drei Sauerstoffatomen zu erklären. Benjah-BMM27 [Public Domain]. Quelle: Wikimedia Commons.
Nitrat -Ionenresonanzstrukturen Nr3-, Um die gerechte Verteilung der negativen Belastung zwischen den drei Sauerstoffatomen zu erklären. Benjah-BMM27 [Public Domain]. Quelle: Wikimedia Commons. Nomenklatur
-Anhydro -Magnesiumnitrat: mg (Nein3)2
Kann Ihnen dienen: destilliertes Wasser-Dihydratisiertes Magnesiumnitrat: mg (nein3)2 •2H2ENTWEDER
-Hexahydrat -Magnesiumnitrat: mg (nein3)2 •6h2ENTWEDER
-Magnesiumdinitrat
Eigenschaften
Körperlicher Status
-Mg (nein3)2 Wasserfrei: weiße feste, kubische Kristalle.
-Mg (nein3)2 Dihydrado: kristalliner weißer Feststoff.
-Mg (nein3)2 Hexahidered: farblose feste, monokline Kristalle
Molekulargewicht
-Mg (nein3)2 Wasservertret: 148,31 g/mol
-Mg (nein3)2 Hexahydrat: 256,41 g/mol
Schmelzpunkt
-Mg (nein3)2 Hexahydrat: 88,9 ºC
Siedepunkt
-Mg (nein3)2 Hexahydrat: Nicht kochen, bei 330 ° C zersetzen
Dichte
-Mg (nein3)2 Wasserfrei: 2,32 g/cm3
-Mg (nein3)2 Dihydrared: 1.456 g/cm3
-Mg (nein3)2 Hexahydrat: 1.464 g/cm3
Löslichkeit
Anhydro -Magnesiumnitrat ist in Wasser sehr löslich: 62,1 g/100 ml bei 0 ºC; 69,5 g/100 ml bei 20 ºC. Es ist auch sehr hygroskopisch und in Kontakt mit der Luft bildet schnell Hexahydrat.
Das mg (nein3)2 Dihydrado ist auch sehr löslich in Wasser und Ethanol. Es ist hygroskopisch.
Das mg (nein3)2 Hexahydrat ist auch sehr löslich im Wasser. Es ist mäßig löslich in Ethanol. Es ist der stabilste von den drei in Kontakt mit der Luft, dh der drei, die am wenigsten Wasser aus der Umwelt absorbiert.
Heizungseffekt
Durch die Einreichung einer wässrigen Lösung von Mg (Nein3)2 Um das Wasser zu verdunstet, ist das Salz, das kristallisiert, Hexahydrat: mg (nein3)2 •6h2ENTWEDER. Hexahydrat bedeutet, dass in dem festen mg -Molekül im festen mg (nein3)2 Es ist mit 6 Wassermolekülen verbunden.
Es gibt auch Mg Dihydrat (nein3)2 •2H2Oder, in dem der mg (nein3)2 Feststoff ist an 2 Wassermolekülen befestigt.
Erhitzen mg Hexahydrat (nein3)2 •6h2Oder das Anhydra -Salz wird nicht erhalten, da Magnesiumnitrat eine hohe Affinität zum Wasser aufweist.
Aus diesem Grund, indem er es über seinem Schmelzpunkt erhitzt, ist ein gemischtes Nitratsalz und ein Magnesiumhydroxid -MG (nein3)2 •4mg (OH)2.
Dieses gemischte Salz zersetzt sich, wenn es 400 ° C erreicht, auf Magnesiumoxid und Ablösung Stickoxidegase.
Es kann Ihnen dienen: Calciumhypochlorit (CA (CLO) 2)Erhalten
Es kann durch Reagieren von MGCO -Magnesiumcarbonat hergestellt werden3 Mit Salpetersäure hno3, Kohlendioxid aufgeben2:
MGCO3 + 2 Hno3 → mg (nein3)2 + CO2↑ + h2ENTWEDER
Es kann auch mit MG (OH) Magnesiumhydroxid erhalten werden2 und Salpetersäure:
Mg (OH)2 + 2 Hno3 → mg (nein3)2 + 2 h2ENTWEDER
Kommerziell auf verschiedene Arten erhalten:
1-reagierende Magnesio mg mit Salpetersäure-HNO3.
2- Durch die Reaktion von MGO Magnesiumoxid mit Salpetersäure HNO3.
3- MG (OH) Magnesiumhydroxid beizutragen2 und NH -Ammoniumnitrat4NEIN3, Bildung von Magnesiumnitrat mit NH -Ammoniakablösung3.
Ort in der Natur
Das mg (nein3)2 Hexahydrat ist natürlich in Minen und Höhlen oder Höhlen in Form eines Nitromagnesit -Minerals zu finden.
Dieses Mineral ist vorhanden, wenn der Guano mit reichen Felsen in Magnesium in Kontakt kommt. Das Guano ist das Material, das sich aus dem Ausdruck von Meeresvögeln und Dichtungen in sehr trockenen Umgebungen ergibt.
Anwendungen
Das mg (nein3)2 Hexahydrat wird in der Keramik-, Chemie- und Landwirtschaftsbranche verwendet.
Diese Verbindung ist ein Dünger, da sie Stickstoff (N) liefert, was eines der drei Grundelemente ist, die von Pflanzen benötigt werden, und Magnesium (Mg), was auch eine sekundäre Komponente ist.
Auf diese Weise wird es mit anderen Zutaten in Gewächshäusern und in hydroponischer Kultur verwendet. Letzteres ist, Pflanzen in einer wässrigen Lösung mit Düngemittelsalzen anstelle von Boden zu wachsen.
 Hydroponische Kultur. Sie können die Kanäle sehen, durch die die wässrige Lösung mit Düngemittelsalzen wie MG Magnesium -Nitrat zirkuliert (nein3)2. Autor: Marsraw. Quelle: Pixabay.
Hydroponische Kultur. Sie können die Kanäle sehen, durch die die wässrige Lösung mit Düngemittelsalzen wie MG Magnesium -Nitrat zirkuliert (nein3)2. Autor: Marsraw. Quelle: Pixabay. Es wird auch als Katalysator für die Erlangung petrochemischer Verbindungen verwendet. Ermöglicht Sie, die Viskosität in bestimmten Prozessen anzupassen. Anhydro -Magnesiumnitrat wird in Pyrotechniken verwendet, dh für die Herstellung von Feuerwerkskörpern.
 Feuerwerkskörper enthalten MG Magnesiumnitrat (nein3)2. Autor: Free-Goos. Quelle: Pixabay.
Feuerwerkskörper enthalten MG Magnesiumnitrat (nein3)2. Autor: Free-Goos. Quelle: Pixabay. Anhydro -Magnesiumnitrat ist ein Dehydriermittel. Es wird zum Beispiel verwendet, um konzentrierte Salpetersäure zu erhalten, da es Wasser eliminiert und Säuredämpfe bis zu 90-95% der HNOs konzentriert3.
Kann Ihnen dienen: Diagonale Regel Konzentrierte Salpetersäure. Der ursprüngliche Uploader war bei italienischen Wikipedia fabelhaft. [GFDL (http: // www.Gnu.Org/copyleft/fdl.html)]. Quelle: Wikimedia Commons.
Konzentrierte Salpetersäure. Der ursprüngliche Uploader war bei italienischen Wikipedia fabelhaft. [GFDL (http: // www.Gnu.Org/copyleft/fdl.html)]. Quelle: Wikimedia Commons. Es wird auch verwendet, um Ammoniumnitrat zu bedecken und die Bildung von Perlen solcher Druckmaterial zu ermöglichen.
Es verfügt über Nützlichkeit in Tintenformulierung, Toner (Schwarzpulver, das in fotokopierten Systemen verwendet wird) und Färbungsprodukte. Es dient als Magnesiumstandard in der analytischen Chemie.
Magnesium- und Cerio -Mg -Nitratsalz (nein3)2 •Stirnrunzeln3)3 Für Physikversuche bei niedrigen Temperaturen ist es von Interesse, da es als Kältemittel in adiabatischen Sumagnetisierungsexperimenten verwendet wird (ohne Wärmeübertragung).
Dieses Magnesium- und Cerio -Salz wurde verwendet, um extrem niedrige Temperaturen der Kelvin -Skala zu ermitteln (nahe an absoluter Null).
In jüngsten Studien
Mehrere Forscher haben Mg verwendet (nein3)2 In Zusammensetzungen mit synthetischen und natürlichen Polymeren, um die Leitfähigkeit in Magnesio -Batterien zu erhöhen.
Es wurde auch beim Bau von Supercaugades für die Energiespeicherung mit hoher Leistung untersucht.
In Krankheitsstudien
Magnesiumnitrat wurde Laborratten mit arterieller Hypertonie (hoher Druck) verabreicht, und es wurde festgestellt.
Es hat auch schützende Wirkungen gegen neurologische Störungen (Störung in Neuronen) und gegen den Tod bei Ratten während der Kaktonierungsprozesse der Karotisarterie gezeigt.
Verweise
- Qian, m. et al. (2018). Extrainarische poröse wenige Schichten Kohlenstoffe mit hoher Kapazität durch Pechini-Verbrennung von Magnesiumnitratgel. ACS Appl Mater Grenzflächen 2018, 10 (1): 381-388. NCBI erholte sich.NLM.NIH.Regierung.
- Manjuladevi, r. et al. (2018). Eine Studie zum Mischpolymerelektrolyten basierend auf Poly. Ionics (2018) 24: 3493. Link wiederhergestellt.Springer.com.
- Kiruthika, s. et al. (2019). Ökofreundlicher Biopolymerelektrolyt, Pektin mit Magnesiumnitratsalz, für die Anwendung in elektochemischen Geräten. J Solid State Electochem (2019) 23: 2181. Link wiederhergestellt.Springer.com.
- Vilskerts r. et al. (2014). Magnesiumnitrat schwächt den Blutdruckanstieg bei SHR -Ratten ab. Magnes Res 2014, 27 (1): 16-24. NCBI erholte sich.NLM.NIH.Regierung.
- Kuzenkov v.S. und Krothinskii a.L. (2014). Schutzwirkung von Magnesiumnitrat gegen neurologische Störungen, die durch zerebrale Ischämie bei Ratten provoziert wurden. Bull Exp Biol Med 2014, 157 (6): 721-3. NCBI erholte sich.NLM.NIH.Regierung.
- Ropp, r.C. (2013). Gruppe 15 (N, P, AS, SB und Bi) Alkalische Erdverbindungen. Magnesiumnitrat. In Enzyklopädie der alkalischen Erdverbindungen. Von Scientedirect erholt.com.
- Kirk-Othmer (1994). Enzyklopädie der chemischen Technologie. Band 1. Vierte Edition. John Wiley & Söhne.
- ODER.S. Nationalbibliothek für Medizin. (2019). Magnesiumnitrat. Erholt von: Pubchem.NCBI.NLM.NIH.Regierung.
- « Konzept und Eigenschaften des technischen Systems, Elemente, Beispiele
- Massenzahl, woraus es besteht und wie man es bekommt (mit Beispielen) »

