Bleinitratstruktur, Eigenschaften, erhalten, verwendet, verwendet, verwendet

- 1147
- 229
- Luca Holdt
Er Bleinitrat o Bleinitrat (II) ist eine anorganische Verbindung, die durch Bleielemente (PB), Stickstoff (N) und Sauerstoff (o) gebildet wird. Blei wird als Ion PB gefunden2+ Und Stickstoff und Sauerstoff bilden das Nitrationion3-.
Seine chemische Formel ist PB (nein3)2. Es ist ein weißer kristalliner Feststoff, der sehr löslich in Wasser ist, wo es Pb -Ionen bildet2+ und nicht3-. Es ist auch als Plumbose -Nitrat bekannt, da Blei in seinem niedrigsten Oxidationszustand liegt.
 Solide Blei -Nitrat. ONDřEJ MANGL / PUB DOMAIN. Quelle: Wikimedia Commons.
Solide Blei -Nitrat. ONDřEJ MANGL / PUB DOMAIN. Quelle: Wikimedia Commons. Es hat stark oxidierende Eigenschaften und wird daher in Anwendungen verwendet, in denen dieses Merkmal erforderlich ist, z. B. bei der Herstellung verschiedener organischer Verbindungen und als Laborreagenz.
In der Vergangenheit wurde es weithin zur Herstellung von Bleifarben verwendet, in denen es auch als Fixierer der Farben in den Geweben fungierte. Diese Anwendung wurde aufgrund der Blei -Toxizität aufgegeben.
Es wurde in der metallurgischen Industrie auf verschiedene Weise verwendet, und in letzter Zeit wurde festgestellt.
Es ist jedoch eine gefährliche Substanz, weil sie die Feuererzeugung bevorzugen kann. Es ist auch giftig für Menschen, Tiere und Pflanzen, daher sollte es niemals in der Umwelt verworfen werden.
[TOC]
Struktur
Es ist eine ionische Verbindung, die durch ein PB -Kation gebildet wird2+ und zwei Anionen nein3-. Im Nitratanion -Sauerstoff sind symmetrisch um Stickstoff und alternative Doppelbindung angeordnet.
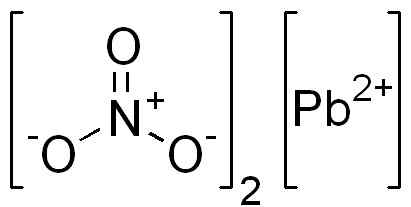 PB -Struktur (nein3)2. Edgar181 / Pub -Domäne. Quelle: Wikimedia Commons.
PB -Struktur (nein3)2. Edgar181 / Pub -Domäne. Quelle: Wikimedia Commons. 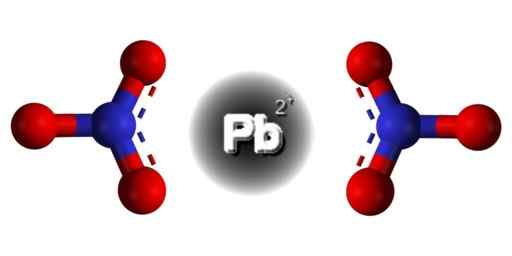 Räumliche Struktur von Pb (nein3)2. Grau = Blei; Blau = Stickstoff; Rot = Sauerstoff. Claudio Pistilli/CC BY-S (https: // CreePecommons.Org/lizenzen/by-sa/4.0). Quelle: Wikimedia Commons.
Räumliche Struktur von Pb (nein3)2. Grau = Blei; Blau = Stickstoff; Rot = Sauerstoff. Claudio Pistilli/CC BY-S (https: // CreePecommons.Org/lizenzen/by-sa/4.0). Quelle: Wikimedia Commons. Die Blei in dieser Verbindung hat die folgende elektronische Konfiguration:
[Xe] 4F14 5D10 6S2 6P0, wo beobachtet wird, dass es die 2 Elektronen der letzten Schicht verloren hat.
Kann Ihnen dienen: Was ist das elektronegativste Element und warum?Nomenklatur
- Bleinitrat
- Bleinitrat (II)
- Plumboso -Nitrat
- Dinitrate führen
Eigenschaften
Körperlicher Status
Weißer oder farbloser kristalline Feststoff. Kubikkristalle.
Molekulargewicht
331 g/mol
Schmelzpunkt
470 ºC. Nach einigen Quellen zersetzt es sich bei dieser Temperatur.
Dichte
4,53 g/cm3
Löslichkeit
Sehr löslich im Wasser: 59,7 g/100 ml Wasser bei 25 ° C. Etwas löslich in Ethanol. In Salpetersäure (HNO3) konzentriert.
pH
Eine wässrige Lösung mit 20% PB (nein3)2 Es hat einen pH-Wert von 3,0-4.0.
Chemische Eigenschaften
Ist ein Oxidationsmittel. Reagiert heftig mit brennbaren Materialien und Reduzierern.
Es ist kein Kraftstoff, kann das Verbrennen von Materialien beschleunigen, die sind. Wenn Sie sich zu seiner Zersetzung erhitzen, emittiert giftige Stickoxidgase:
2 PB (nein3)2 + Wärme → 2 pbo + 4 nein2↑ + o2↑
Beim Auflösen in Wasser wird es ionisiert:
Pb (nein3)2 + H2O → Pb2+ + 2 Nr3-
Erhalten
Es kann durch Reagieren von metallischen Blei, Bleimonoxid (PBO) oder Blei -Carbonat hergestellt werden3 Mit Salpetersäure. Es ist zweckmäßig, Säureüberschüsse zu verwenden, um grundlegende Nitrate zu verhindern.
Pbo + 2 hno3 (konzentriert) → Pb (nein3)2↓+ h2ENTWEDER
Anwendungen
In organisch
Die Oxidationskapazität wird bei der Herstellung verschiedener Verbindungen angewendet.
Es wurde verwendet, um Calixarenos zu synthetisieren, bei denen es sich um organische Verbindungen handelt, deren Molekül die Form eines Korbs hat, der es ermöglicht, andere Substanzen abhängig von der Verwendung zu unterbringen, die ihm gegeben wird.
Es dient dazu, Isotiocianate (R-CS) ab Aminen (R-NH) zu erhalten2).
Es wird im industriellen Maßstab verwendet, um Benzaldehyd -oxidierende Benchilo -Chlorid vorzubereiten. Es dient auch als Katalysator für die Veresterung organischer Verbindungen, zum Beispiel bei der Erlangung von Polyestern.
In chemischer Analyse
Es wird als Reagenz zur Bestimmung von Aluminium und Blei in Mineralien und Felsen verwendet.
In der Färbung von Textilfasern
Einige Chromfarbstoffe benötigen die Verwendung von PB (nein3)2 erhalten. Zum Beispiel ist es mit Bleinitrat bedeckt und mit Natriumsulfat behandelt, um Bleisulfat zu produzieren.
Kann Ihnen dienen: gleichwertiges GewichtDann wird eine verdünnte Lösung von Natriumdichromat angewendet, um ein Bleichromat zu bilden (PBCRO4) Das ist ein gelbes Pigment.
 Vor einer Zeit waren gelbe Stoffe mit Pigmenten gefärbt, deren Ausgangspunkt PB war (nein3)2. Dies geschieht nicht durch Blei -Toxizität. Autor: 3D -Animationsproduktionsfirma. Quelle: Pixabay.
Vor einer Zeit waren gelbe Stoffe mit Pigmenten gefärbt, deren Ausgangspunkt PB war (nein3)2. Dies geschieht nicht durch Blei -Toxizität. Autor: 3D -Animationsproduktionsfirma. Quelle: Pixabay. Heute wurden jedoch die Bleipigmente für ihre Toxizität gestoppt.
Es wirkt auch als Unterricht, um die Farbstoffe während der Farbe oder des Drucks anderer Faserarten zu fixieren.
Im Medina Veterinär
Es wurde früher als ätzendes Mittel bei der Behandlung von Chancros oder Gangrenas bei Pferden eingesetzt.
In der Metallindustrie
Bleinitrat wird bei der elektrolytischen Raffination von Blei als Mittel zur Bevorzugung der Flotation bei der Entfernung von Titan bestimmter Tonen ermöglicht, Edelmetalle von Cyanidlösungen wiederherzustellen und wird in der PBO -Elektrode verwendet2 bei Nickel Anoden.
In Solarzellen
Es wurde in Form einer wässrigen Lösung verwendet, um Solarzellen basierend auf Perovskita, einem Titanoxid -Mineral, herzustellen.
Das synthetisierte Material ist ein organometallisches oder perverskita Bleijodid, das die Aufmerksamkeit der Forscher auf sich gezogen hat.
Diese Eigenschaften machen es zu einem hervorragenden Kandidaten für Photovoltaikgeräte, dh sie verwandeln Licht in elektrische Strom.
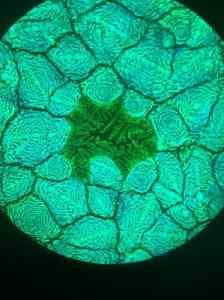 Mikrofotografie der Struktur von UNAVSKITA von Bleihalogenid mit Fluoreszenzmikroskop. Furava/CC von (https: // creativecommons.Org/lizenzen/bis/4.0). Quelle: Wikimedia Commons.
Mikrofotografie der Struktur von UNAVSKITA von Bleihalogenid mit Fluoreszenzmikroskop. Furava/CC von (https: // creativecommons.Org/lizenzen/bis/4.0). Quelle: Wikimedia Commons. Andere Apps
Er (pbno3)2 Es wurde auch verwendet:
- Bei der Herstellung von Spielen bestimmte Sprengstoff und pyrotechnische Materialien,
- In der Fotografie als Sensibilisierungsmittel zur Abdeckung des Papiers in der Photothermographie,
- In der Textilindustrie, um Rayon zu verbessern und Nylon zu stabilisieren,
- Bei der Beseitigung von Nagetieren.
 Bleinitrat wurde zur Herstellung von Feuerwerkskörpern oder pyrotechnischem Material verwendet. Autor: Free-Goos. Quelle: Pixabay.
Bleinitrat wurde zur Herstellung von Feuerwerkskörpern oder pyrotechnischem Material verwendet. Autor: Free-Goos. Quelle: Pixabay. Risiken
Feuer und Explosion
Obwohl es sich nicht um eine Brennstoffverbindung handelt, kann es explodieren, wenn es dem Feuer oder der Wärme ausgesetzt ist, wodurch toxische Stickoxide erzeugt werden.
Als stark oxidierender Mittel besteht die Gefahr, dass ein Feuer erzeugt wird, wenn es mit organischen Materialien in Kontakt kommt.
Für die Gesundheit
Erzeugt Augenreizung, Atemweg und Verdauungstrakt. Es ist durch Inhalation und Aufnahme giftig. Die häufigsten Symptome der Vergiftung durch diese Verbindung sind Magen -Darm, Kolik, Verstopfung und Schwäche, die unter anderem unter anderem zu Lähmung werden können.
Seine Einnahme kann auch Schmerzen, Krämpfe, Depressionen, Koma und Tod verursachen.
Für die natürliche Umwelt
Es ist giftig für Wasser- und Landorganismen, außerdem sind ihre Schäden anhaltend und bioakkumula in Lebewesen, daher gilt es als gefährlicher Schadstoff und sollte nicht in die Umwelt verworfen werden.
Wenn es versehentlich in Wasser verschüttet wird, sollte es mit Calciumoxid (CAO), Calciumcarbonat (Caco) neutralisiert werden3) oder Natriumbicarbonat (Nahco3).
Es wurde bestätigt, dass es Karzinogen für Tiere und möglicherweise für den Menschen ist.
Verweise
- ODER.S. Nationalbibliothek für Medizin. (2019). Blei (ii) Nitrat. Aus Pubchem geborgen.NCBI.NLM.NIH.Regierung.
- Hsih, t.UND. et al. (2015). Effiziente posvskit. Chem -Kommunikation (Veränderung). 2015 4. September; 51 (68): 13294-7. NCBI erholte sich.NLM.NIH.Regierung.
- Vratny, f. und Gugliotta, f. (1963). Die themalische Zerlegung von Bleinitrat. J. Inorg. Nukl. Chem., 1963, vol. 25, pp. 1129-1132. Von Scientedirect erholt.com.
- Chakraborty, j.N. (2014). Färben mit Mineralfarben. In Fonds und Praktiken in der Farbfarbe von Textilien. Von Scientedirect erholt.com.
- Kumari, h. und Atwood, J. (2017). Calixarene im Feststaat. In Bezug. Von Scientedirect erholt.com.
- Jeffery, p.G. und Hutchison, D. (1981). Aluminium. In chemischen Methoden der Rockanalyse (dritte Ausgabe). Von Scientedirect erholt.com
- Sandler, s.R. und Karo, w. (1992). Cyanate, Isocyanate, Thiocyanate und Isothiocyanate. In SourceBook of Advanced Organic Laboratory Preparations. Von Scientedirect erholt.com.
- Smith, p.W.G. et al. (1969). Aromatische Halogenverbindungen. In der aromatischen Chemie. Von Scientedirect erholt.com.
- Baumwolle, f. Albert und Wilkinson, Geoffrey. (1980). Fortgeschrittene anorganische Chemie. Vierte Edition. John Wiley & Söhne.
- Blei, d.R. (Herausgeber) (2003). CRC -Handbuch für Chemie und Physik. 85th CRC Press.
- Wikimedia Foundation (2020). Blei (ii) Nitrat. Abgerufen von.Wikipedia.Org.
- Shinde, d.V. et al. (2017). Verbesserte Effizienz und Stabilität einer wässrigen auf Blei-Nitratbasis basierenden organometalllischen Perowskit-Solarzellenzelle. ACS Appl. Mater. 2017 Schnittstellen, 9, 14023-14030. Aus Pubs geborgen.ACS.Org.
- « Phenole oder Phenolverbindungen Eigenschaften, Typen, Anwendungen
- Bleiacetatstruktur, Eigenschaften, erhalten, verwendet, verwendet »

