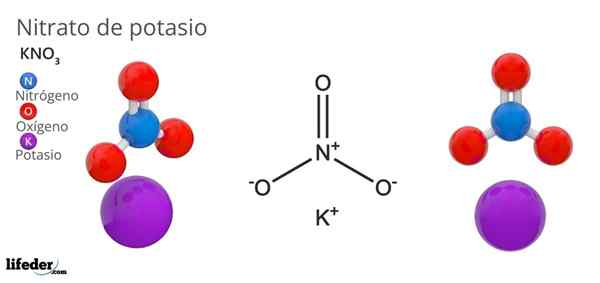
Kaliumnitrat (KNO3)
- 3898
- 1103
- Medine Kedzierski
Was ist Kaliumnitrat?
Er Kaliumnitrat Es ist ein ternäres Salz, das aus Kalium, alkalischem Metall und Nitratoxoanion besteht. Seine chemische Formel ist Kno3, Das bedeutet das für jedes k Ion+, Es gibt kein Ion3-- mit diesem interagieren. Daher ist es ein ionisches Salz und bildet einen der alkalischen Nitrate (Lino3, Älterer Bruder3, Rbno3…).
Der Kno3 Es ist ein starkes Oxidationsmittel aufgrund des Vorhandenseins von Nitratanion. Das heißt, es funktioniert als Reserve von festen Nitrationen, im Gegensatz zu anderen hochlöslichen Salzen in Wasser oder sehr hygroskopisch. Viele der Eigenschaften und Verwendungen dieser Verbindung sind eher auf das Nitratanion als auf das Kaliumkation zurückzuführen.
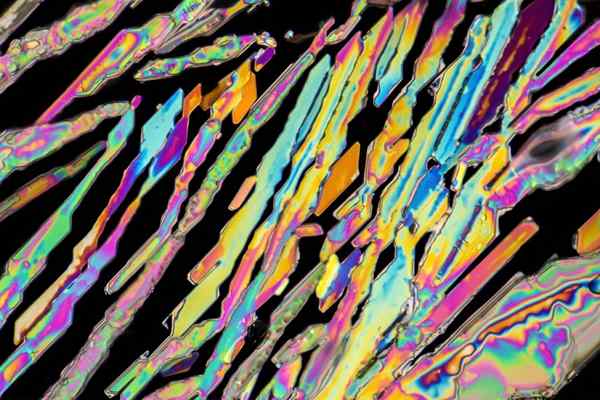 Kaliumnitratkristalle
Kaliumnitratkristalle Im oberen Bild werden einige KNO -Kristalle veranschaulicht3 mit Nadelformen. Die natürliche KNO -Quelle3 ist der Salpeter, der als Namen bekannt ist Saltpeter entweder Ballon, auf Englisch. Dieses Element ist auch als Kali- nitrat oder Nitro -Mineral bekannt.
Es befindet sich in ariden oder Wüstengebieten sowie aus Ausblühen der höhlenartigen Wände. Eine weitere wichtige Quelle von KNO3 Es ist der Guano, der Tiere ausgeht, die trockene Umgebungen bewohnen.
Chemische Struktur von Kaliumnitrat
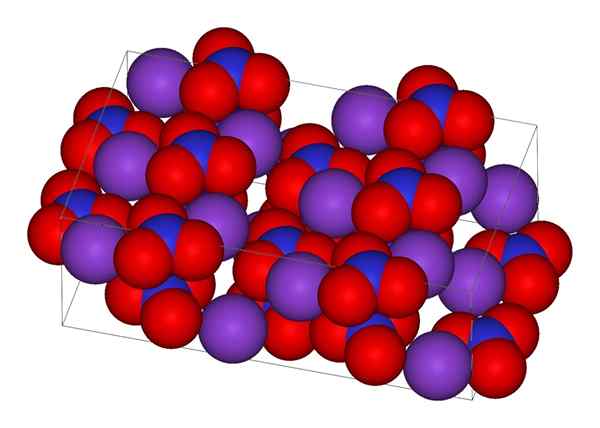 Kristallstruktur von Kaliumnitrat
Kristallstruktur von Kaliumnitrat Im oberen Bild wird die kristalline Struktur des KNO dargestellt3. Lila Kugeln entsprechen Kionen+, während Rot und Blau Sauerstoff- und Stickstoffatome sind. Die kristalline Struktur ist bei Raumtemperatur ortorrombisch.
Nion Geometrie Nr3- Es ist die einer trigonalen Ebene mit den Sauerstoffatomen in den Eckpunkten des Dreiecks und des Stickstoffatoms in seiner Mitte. Es zeigt eine positive formale Belastung im Stickstoffatom und zwei negative formale Belastungen in zwei Sauerstoffatomen (1-2 = (-1)).
Kann Ihnen dienen: Einfaches MikroskopDiese beiden negativen Gebühren von NO3- Sie wechseln zwischen den drei Sauerstoffatomen und behalten immer die positive Belastung im Stickstoff bei. Als Folge der oben genannten Kionen-+ des Kristalls vermeiden sie, knapp über oder unter dem Stickstoff der Anionen zu stehen, nicht3-.
Tatsächlich zeigt das Bild, wie Kionen+ Sie sind von Sauerstoffatomen, roten Kugeln umgeben. Zusammenfassend sind diese Wechselwirkungen für kristalline Anordnungen verantwortlich.
Andere kristalline Phasen
Variablen wie Druck und Temperatur können diese Anordnungen ändern und unterschiedliche strukturelle Phasen für den KNO verursachen3 (Phasen I, II und III). Beispielsweise ist Phase II das des Bildes, während Phase I (mit trigonaler kristalliner Struktur) gebildet wird, wenn die Kristalle bis zu 129 ° C erhitzt werden.
Phase III ist ein Übergangsfest, der aus der Abkühlung von Phase I erhalten wird, und einige Studien haben gezeigt, dass er einige wichtige physikalische Eigenschaften wie Ferroelektrizität aufweist. In dieser Phase bildet der Kristall Kaliumschichten und Nitrate, möglicherweise empfindlich gegenüber elektrostatischen Abstoßungen zwischen Ionen.
In den Schichten von Phase III die Anionen nein3- Sie verlieren ein wenig von ihrer Planarität (die Dreieckskurven leicht), um diese Anordnung zu ermöglichen, die vor jeder mechanischen Störung zur Struktur von Phase II wird.
Kaliumnitrat verwendet/Anwendungen
Salz ist von großer Bedeutung, da es in zahlreichen Aktivitäten des Menschen verwendet wird, die sich in Industrie, Landwirtschaft, Nahrung usw. manifestieren, usw. Diese Verwendungen umfassen Folgendes:
- Lebensmittelkonservierung, insbesondere Fleisch. Trotz des Verdachts, dass es in der Bildung von Nitrosamin (karzinogenes Wirkstoff) interveniert, wird immer noch in Wurstwaren verwendet.
- Dünger, da Kaliumnitrat zwei der drei Pflanzen Makronährstoffe liefert: Stickstoff und Kalium. Zusammen mit Phosphor ist dieses Element für die Entwicklung von Pflanzen notwendig. Das heißt, es ist eine wichtige und überschaubare Reserve dieser Nährstoffe.
- Beschleunigt die Verbrennung und kann in der Lage sein, Explosionen zu produzieren, wenn das brennbare Material umfangreich ist oder fein geteilt ist (größere Oberfläche, größere Reaktivität). Außerdem ist es eine der Hauptkomponenten von Schießpulver.
- Erleichtert die Entfernung der Berührungen der übergewerteten Bäume. Nitrat versorgt den Stickstoff, der für Pilze erforderlich ist, um das Holz von Stümpfen zu zerstören.
- Es interveniert die Verringerung der Zahnempfindlichkeit durch seinen Einbau in Zahnfleisch.
- Interveniert als Hypotensor in der Regulierung des Blutdrucks beim Menschen. Dieser Effekt würde mit einer Änderung der Natriumausscheidung verabreicht oder miteinander verbunden sein. Die empfohlene Dosis in der Behandlung beträgt 40-80 meq/Tag Kalium. In dieser Hinsicht wird darauf hingewiesen, dass Kaliumnitrat diuretische Wirkung haben würde.
Synthese
Der größte Teil des Nitrates wird in den Minen der Wüsten in Chile produziert. Es kann durch verschiedene Reaktionen synthetisiert werden:
NH4NEIN3 (ac) +koh (ac) => nh3 (AC) +Kno3 (Ac)+h2Oder (l)
Kaliumnitrat auch neutralisierende Salpetersäure mit Kaliumhydroxid in einer stark exothermen Reaktion.
Koh (AC) +HNO3(conc) => Kno3 (Ac) +h2Oder (l)
Auf industriellem Maßstab wird Kaliumnitrat durch eine doppelte Verschiebungsreaktion erzeugt.
Älterer Bruder3 (ac) +kcl (ac) => naCl (ac) +Kno3 (Ac)
Die Hauptquelle des KCL stammt aus Silvina Mineral und nicht von anderen Mineralien wie Carnalit oder Kainit, die ebenfalls aus ionischer Magnesium bestehen.
Physikalische und chemische Eigenschaften
Kaliumnitrat im festen Zustand wird als Weiß oder in Form ortorombischer Strukturkristalle bei Umgebungstemperatur und trigonal bei 129 ° C dargestellt. Es hat ein Molekulargewicht von 101.1032 g/mol, es ist Toilette und hat einen Salz -Hektar -Geschmack.
Es handelt+.
Seine Dichte beträgt 2,1 g/cm3 bei 25 ºC. Dies bedeutet, dass es ungefähr doppelt dicht als Wasser ist.
Seine Schmelzpunkte (334 ºC) und das Kochen (400 ºC) weist auf die ionischen Bindungen zwischen k hin+ und nicht3-. Sie sind jedoch im Vergleich zu anderen Salzen niedrig, da die kristalline retikuläre Energie bei monovalenten Ionen (dh mit Lasten ± 1) niedriger ist und auch keine sehr ähnlichen Größen aufweist.
Kann Ihnen dienen: pH -IndikatorenEs zersetzt sich bei einer Temperatur in der Nähe des Siedepunkts (400 ° C), um Kalium und molekularer Sauerstoff zu erzeugen:
Kno3(S) => Kno2(s) + oder2(G)
Verweise
- Pubchem. (2018). Kaliumnitrat. Aus Pubchem geborgen.NCBI.NLM.Nik.Regierung
- Kristallat. (2009). Wachstum und Einzelkristallverfeinerung von Phase-III-Kaliumnitrat, KNO3. B65, 659-663.
- Marni Wolfe. (3. Oktober 2017). Kaliumnitratrisiken. Livestrong erholte sich.com
- Amethyst Galeries, Inc. (1995-2014). Die Mineralniter. Galerien geborgen.com