Zinknitratstruktur, Eigenschaften, erhalten, verwendet, verwendet

- 3909
- 64
- Lewis Holzner
Er Zinknitrat Es ist eine anorganische Verbindung, die vom Zink (Zn), Stickstoff (N) und Sauerstoff (O) (O) (O) gebildet wird. Der Oxidationsstatus des Zink beträgt +2, der des Stickstoffs beträgt +5 und Sauerstoff -2 beträgt -2.
Seine chemische Formel ist Zn (nein3)2. Es ist eine feste farblose Kristalline, die dazu neigt, Wasser aus der Umwelt zu absorbieren. Es kann durch die Behandlung des Zinkmetalls mit verdünntem Salpetersäure erhalten werden. Es ist eine stark oxidierende Verbindung.
 FIFR Zn Nitrat (nein3)2. ONDřEJ MANGL / PUB DOMAIN. Quelle: Wikimedia Commons.
FIFR Zn Nitrat (nein3)2. ONDřEJ MANGL / PUB DOMAIN. Quelle: Wikimedia Commons. Es dient als organische Chemiereaktionen Beschleuniger und ermöglicht es Ihnen, Verbundpolymere mit Elektrizitätsantriebseigenschaften zu erhalten. Es wird verwendet, um nützliche Materialien in der Elektronik zu bilden.
Es ist Teil einiger flüssiger Dünger und bestimmter langsamer Herbizide. Hilfe bei der Herstellung komplexer Oxide, die Ihre Dichte und elektrische Leitfähigkeit verbessern.
Es wurde erfolgreich getestet, um Strukturen zu erhalten, die als Grundlage für die Regeneration und das Wachstum von Knochengewebe dienen, diesen Prozess verbessern und zu einem antibakteriellen Bereich führen.
Obwohl es kein Kraftstoff ist, kann es das Verbrennen von Substanzen wie Kohle oder organische Materialien beschleunigen. Es ist irritierende Haut, Augen und Schleimhäute und ist für das Leben im Wasser sehr giftig.
[TOC]
Struktur
Zinknitrat ist eine ionische Verbindung. Es hat ein bivalentes Kation (Zn2+) und zwei einwertige Anionen (nein3-). Nitratanion ist ein polyiatomisches Ion, das durch ein Stickstoffatom in seinem Oxidationszustand +5 gebildet wird, der an drei Sauerstoffatome mit Valencia von -2 gebunden ist.
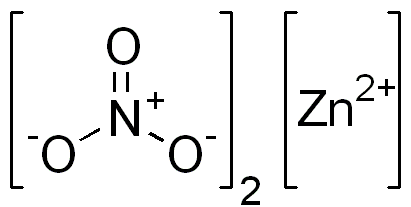 Ionennitratstruktur von Zink. Edgar181 / Pub -Domäne. Quelle: Wikimedia Commons.
Ionennitratstruktur von Zink. Edgar181 / Pub -Domäne. Quelle: Wikimedia Commons. Das Bild unten zeigt die räumliche Struktur dieser Verbindung. Die graue zentrale Kugel ist Zink, blaue Kugeln sind Stickstoff und rote Kugeln repräsentieren Sauerstoff.
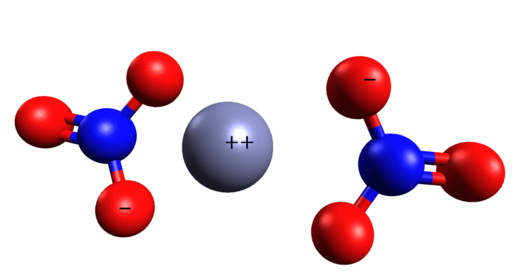 Räumliche Struktur von Zn (nein3)2. Cinc befindet sich in der Mitte der Nitrationen. Grasso Luigi/CC BY-SA (https: // creativecommons.Org/lizenzen/by-sa/4.0). Quelle: Wikimedia Commons.
Räumliche Struktur von Zn (nein3)2. Cinc befindet sich in der Mitte der Nitrationen. Grasso Luigi/CC BY-SA (https: // creativecommons.Org/lizenzen/by-sa/4.0). Quelle: Wikimedia Commons. Nomenklatur
- Cinc Nitrat
- Zinkdinitrate
Eigenschaften
Körperlicher Status
Farbloser fester oder kristalline Weiß.
Molekulargewicht
189,40 g/mol
Schmelzpunkt
Ungefähr 110 ° C.
Es kann Ihnen dienen: iarhydsäure (HI): Struktur, Eigenschaften und VerwendungSiedepunkt
Ungefähr 125 ºC.
Dichte
2.065 g/cm3
Löslichkeit
Wasserlöslich: 120 g/100 g h2Oder bei 25 ° C. Alkohollöslich.
pH
Seine wässrigen Lösungen sind sauer. Eine 5% ige Lösung hat einen pH -Wert von ungefähr 5.
Chemische Eigenschaften
Als Nitrat ist diese Verbindung ein starkes Oxidationsmittel. Reagiert heftig mit Kohle, Kupfer, Metallsulfiden, organischer Substanz, Phosphor und Schwefel. Wenn es auf heiße Kohle -Exploits besprüht wird.
Andererseits ist es hygroskopisch und absorbiert Wasser aus der Umwelt. Wenn Zinkoxid bildet, Stickstoff und Sauerstoffdioxid:
2 Zn (nein3)2 + Wärme → 2 ZnO + 4 nein2↑ + o2↑
In alkalischen Lösungen wie denen von NaOH bildet das Zink dieser Verbindung seinen Hydroxid und andere komplexe Arten:
Zn (nein3)2 + 2 OH- → Zn (OH)2 + 2 Nr3-
Zn (OH)2 + 2 OH- → [Zn (OH)4]2-
Erhalten
Es kann durch die Behandlung von Zink oder Zinkoxid mit verdünntem Salpetersäure erhalten werden. Wasserstoffgas wird in dieser Reaktion gebildet.
Zn + 2 HNO3 → Zn (nein3)2 + H2↑
Anwendungen
Reaktionen Katalyse
Es wird als Katalysator verwendet, um andere chemische Verbindungen wie Harze und Polymere zu erhalten. Es ist ein saurer Katalysator.
 Harz Beispiel. Bugman bei English Wikipedia / Public Domain. Quelle: Wikimedia Commons.
Harz Beispiel. Bugman bei English Wikipedia / Public Domain. Quelle: Wikimedia Commons.  Polymerstrukturmodell. Ilmari Karonen / Pub -Domäne. Quelle: Wikimedia Commons.
Polymerstrukturmodell. Ilmari Karonen / Pub -Domäne. Quelle: Wikimedia Commons. Ein weiterer Fall von Reaktionen Beschleunigung ist das katalytische System von Zn (nein3)2/VOC2ENTWEDER4, Dies ermöglicht die Oxidation von α-Hydrolyster gegenüber α-Zo-Stress mit 99% Umwandlung selbst bei Umweltdruck und Temperatur.
In zusammengesetzten Polymeren
Es wurden Polymethylmetacrylat- und Zn -Filme entwickelt (nein3)2 mit elektrischen Leitfähigkeitseigenschaften, die sie zu geeigneten Kandidaten machen, um in Supercaugen und Computern mit hohen Geschwindigkeiten verwendet zu werden.
In Oxyst Cements
Mit wässrigen Zinknitratlösungen und Zinkoxidpulver werden Materialien zur Klasse von Zementen erhalten, die durch eine Säure-Base-Reaktion erzeugt werden.
Diese haben eine angemessene Resistenz gegen die Auflösung in verdünnten Säuren und Alkalien, wobei die Kompressionsresistenzkomprimierung im Vergleich zu anderen Zemente entwickelt wird.
Diese Eigenschaft steigt, wenn das ZnO/Zn -Verhältnis erhöht ist (nein3)2, Und wenn die Zn -Konzentration hochgeladen wird (nein3)2 In der Lösung. Die erhaltenen Zemente sind völlig amorph, dh sie haben keine Kristalle.
Kann Ihnen dienen: Chemischer Niederschlag Mit Zinknitrat wurden Tests zum Erhalten von Zementen durchgeführt. Autor: Kobthanapong. Quelle: Pixabay.
Mit Zinknitrat wurden Tests zum Erhalten von Zementen durchgeführt. Autor: Kobthanapong. Quelle: Pixabay. In Beschichtungen und Nanomaterialien von Zinkoxid
Der Zn (nein3)2 Es wird zur elektrolytischen Ablagerung sehr dünner Zinkoxidschichten (ZnO) auf verschiedenen Substraten verwendet. Auf den Oberflächen werden auch Nanostrukturen dieses Oxids hergestellt.
 Zinkoxid -Nanopartikel. Einige ZnO -Nanostrukturen können mit Zn (nein3)2. Verena Wilhelmi, Ute Fischer, Heike Waage, Klaus Schulze-Asthoff, Carmen Nickel, Burkhard Stahlmecke, Thomas A. J. Kuhlbusch, Agnes M. Scherbart, Charlotte Esser, Roel P. F. Schins, Catrin Albrecht/CC von (https: // creativecommons.Org/lizenzen/by/2.5). Quelle: Wikimedia Commons.
Zinkoxid -Nanopartikel. Einige ZnO -Nanostrukturen können mit Zn (nein3)2. Verena Wilhelmi, Ute Fischer, Heike Waage, Klaus Schulze-Asthoff, Carmen Nickel, Burkhard Stahlmecke, Thomas A. J. Kuhlbusch, Agnes M. Scherbart, Charlotte Esser, Roel P. F. Schins, Catrin Albrecht/CC von (https: // creativecommons.Org/lizenzen/by/2.5). Quelle: Wikimedia Commons. ZnO ist ein Material von großem Interesse aufgrund der Vielzahl von Anwendungen im Bereich Optolecronics, es hat auch Halbleitereigenschaften und wird in Sensoren und Wandlern verwendet.
In Herbiziden
Cinc -Nitrat wurde zusammen mit einigen organischen Verbindungen verwendet, um die Freisetzungsgeschwindigkeit bestimmter Herbizide in Wasser zu verringern. Die langsame Freisetzung dieser Produkte ermöglicht es ihnen, länger zu verfügbar zu sein, und weniger Anwendungen sind erforderlich.
In der Anod -Herstellung
Stimuliert den Sinterprozess und verbessert die Dichte bestimmter Oxide, die dazu dienen, Anods für Brennstoffzellen zu machen. Sintern erhält ein festes Material durch die Erhitzen und Komprimierung eines Pulvers, ohne seine Fusion zu erreichen.
 Zeichnen, wie zwei Körner das Sintern auftreten. Der Zn (nein3)2 Hilfe bei der Ausführung dieses Prozesses bei einigen komplexen Oxiden. CDang / Pub -Domäne. Quelle: Wikimedia Commons.
Zeichnen, wie zwei Körner das Sintern auftreten. Der Zn (nein3)2 Hilfe bei der Ausführung dieses Prozesses bei einigen komplexen Oxiden. CDang / Pub -Domäne. Quelle: Wikimedia Commons. Die Materialien, in denen die Tests durchgeführt wurden. Das Vorhandensein von FAL erhöht die elektrische Leitfähigkeit von diesen signifikant.
Andere Apps
Es wird zum Erhalten von Medikamenten verwendet. Es fungiert als Unterricht bei der Anwendung von Tinten und Farbstoffen. Dient als Latexkoagulans. Es ist eine Quelle von Zink und Stickstoff in Flüssigkeitsdünger.
Potenzielle Verwendung im Knochentissue -Engineering
Diese Verbindung wurde als Additiv bei der Ausarbeitung von Rüstung oder Rahmen für die Regeneration von Knochenfasern verwendet, da sie den mechanischen Widerstand dieser Strukturen verbessern kann.
Kann Ihnen dienen: Deutschio: Geschichte, Eigenschaften, Struktur, Erhalten, VerwendungenEs wurde beobachtet, dass das Gerüst, das Fift enthält.
Bevorzugt die Bildung von Apatita, das das Mineral ist, das die Knochen bildet und auch eine antibakterielle Wirkung ausübt.
 Der Zn (nein3)2 Es könnte sehr nützlich für die Rekonstruktion von Knochensache bei Menschen sein, die Unfälle erlitten haben. Mariano Coretti/CC BY-SA (https: // creativecommons.Org/lizenzen/by-sa/4.0). Quelle: Wikimedia Commons.
Der Zn (nein3)2 Es könnte sehr nützlich für die Rekonstruktion von Knochensache bei Menschen sein, die Unfälle erlitten haben. Mariano Coretti/CC BY-SA (https: // creativecommons.Org/lizenzen/by-sa/4.0). Quelle: Wikimedia Commons. Risiken
Es ist ein Material mit potenziellem Risiko von Feuer und Explosion.
Es ist nicht Kraftstoff, sondern beschleunigt das Verbrennen brennbarer Materialien. Wenn eine große Menge dieser Verbindung an einem Brand verwickelt ist oder wenn das brennbare Material fein geteilt ist, kann eine Explosion auftreten.
Bei starker Wärme werden giftige Stickoxide erzeugt. Und wenn die Belichtung verlängert wird, kann sie explodieren.
Es ist irritierend für die Haut, kann die Augen, Reizungen im Atemweg, ernsthafte Schäden verursachen, es ist giftig aufgrund der Aufnahme und verursacht Schäden am Verdauungstrakt.
Sehr giftig für das Wasserleben mit dauernden Effekten.
Verweise
- Ju und. et al. (2019). Neuartige Wirkung von Zinknitrat/Vanadyloxalat zur selektiven katalytischen Oxidation von Alpha-Hydroxyester an Alfa-Keto-Eser mit molekularem Sauerstoff: Ein in situ. Moleküle 2019, 24, 1281. MDPI erholt sich.com.
- Mohd s., S.N. et al. (2020). Controllierte Freisetzung Formulierung von Zinkhydroxidnitrat, die mit Natriumdodecylsulphe und Bispyribac -Anionen interkaliert ist: ein neuartiger Herbizid -Nanokomposit für die Reisanbindung. Arabian Journal of Chemistry 13, 4513-4527 (2020). Von Scientedirect erholt.
- Mann, m.P. et al. (2019). Angereicherte mechanische Festigkeit und Knochenmineralisierung des elektrogesponnenen biomimetischen Gerüsts mit Ylang Ylang -Öl und Zinknitrat für Knochentissue -Engineering. Polymers 2019, 11, 1323. MDPI erholt sich.com.
- Kim, k.Yo. et al. (2018). Auswirkungen von Zinknitrat als Sinterhilfe auf die elektochemischen Eigenschaften von SR0,92UND0,08Onkel3-Delta und MR0,92UND0,08Du0,6Glaube0,4ENTWEDER3-Delta Ceramics International, 44 (4): 4262-4270 (2018). Von Scientedirect erholt.com.
- Prasad, geb.UND. et al. (2012). Elektrodeposition der ZnO -Beschichtung von wässrigen Zn (nein3)2 Bäder: Auswirkung der Zn -Konzentration, der Temperaturabscheidung und der Zeit auf die Orientierung. J Solid State Electochem 16, 3715-3722 (2012). Link wiederhergestellt.Springer.com.
- Bahadur, h. und srivastava, zu.K. (2007). Morphologien von Sol-Gel-Dünnfilmen von ZnO unter Verwendung verschiedener Vorläufermaterialien und deren Nanostrukturen. Nanoscale Res Lett (2007) 2: 469-475. Link wiederhergestellt.Springer.com.
- Nicholson, J.W. und Tibaldi, J.P. (1992). Bildung und Eigenschaften von Zement aus Zinkoxid und wässrigen Lösungen von Zinknitrat. J Mater Sci 27, 2420-2422 (1992). Link wiederhergestellt.Springer.com.
- Blei, d.R. (Herausgeber) (2003). CRC -Handbuch für Chemie und Physik. 85th CRC Press.
- Maji, p. et al. (2015). Wirkung von Zn (nein3)2 Füllstoff auf der dielektrischen Erdillität und dem elektrischen Modul von PMMA. Bull Mater Sci 38, 417-424 (2015). Link wiederhergestellt.Springer.com.
- ODER.S. Nationalbibliothek für Medizin. (2019). Zinknitrat. Aus Pubchem geborgen.NCBI.NLM.NIH.Regierung.
- Byju. (2020). Zinknitrat - Zn (NO3) 2. Von Byjus geborgen.com.
- Amerikanische Elemente. Zinknitrat. Von Amerikanern erholt.com.
- Baumwolle, f. Albert und Wilkinson, Geoffrey. (1980). Fortgeschrittene anorganische Chemie. Vierte Edition. John Wiley & Söhne.
- « Zinkchlorid (ZNCL2) -Struktur, Eigenschaften, erhalten, verwendet, verwendet
- Konkrete Fälle von ethischem Verfahren in Institutionen und Organisationen »

