Nitratseigenschaften, Struktur, Nomenklatur, Schulung
- 4084
- 1060
- Luca Holdt
Der Nitrate Sie sind all jener Verbindungen, die Anion nicht enthalten3-, Wenn es um anorganische Salze oder die Nitro -Gruppe geht, -anono2, Im Falle von organischen Derivaten. In anorganischen Nitraten handeltN+NEIN3-.
Zum Beispiel Natriumnitrat3, Es wird von NA -Ionen gebildet+ und nicht3-. Dieses Salz zusammen mit Kaliumnitrat, Kno3, sind die am häufigsten vorkommenden Nitrats -Exemplare in der Natur. Nitrate finden in den Böden, in Pflanzengeweben und vor allem in Meeren und Kochsalzlösung wie Salitre in Chile.
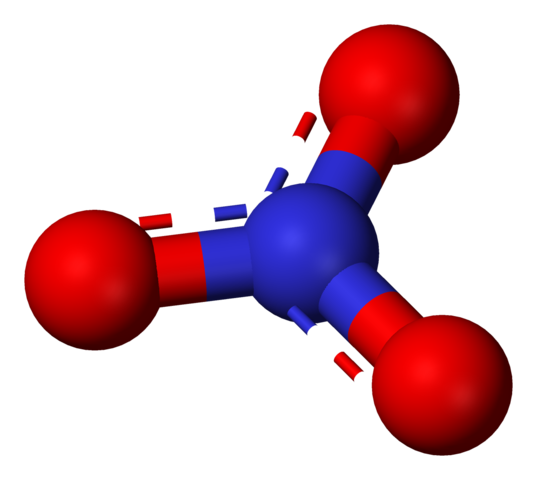
 Nitratanion, dargestellt durch ein Modell von Kugeln und Balken. Quelle: Benjah-BMM27 / Public Domain.
Nitratanion, dargestellt durch ein Modell von Kugeln und Balken. Quelle: Benjah-BMM27 / Public Domain. Der Begriff „Nitrate“ spielt sofort auf Salze, Düngemittel und Sprengstoff an. Sie hängen auch mit Fleisch und ihren Härtungsverfahren zusammen, um das Wachstum von Bakterien zu hemmen und damit ihre Verschlechterung zu verzögern. Nitrate sind auch Synonyme für Gemüse, da sie hohe Mengen dieser Salze enthalten.
Tut er nicht3- (Überlegenes Bild) ist die am stärksten oxidierte Form von Stickstoff, die das endgültige und assimilable Produkt seines biologischen Zyklus ist. Der Stickstoff der Atmosphäre leidet unter mehreren Transformationen, entweder durch die Arbeit von Elektrostrahlen oder durch mikrobielle Wirkungen, um NH zu werden4+ und nicht3-, beide löslich in Wasser und absorbierbar durch Pflanzen.
Nitrate werden als Oxidationsmittel, Düngemittel, Sprengstoff und kardiologische Medikamente verwendet. Diese letzte Verwendung steht im Gegensatz zu anderen gegenüber, da sie den Körper so metabolisieren oder mit dem Körper interagieren, so dass sie die Venen und Arterien erweitern. Und deshalb steigt und verbessert es den Blutfluss, lindert Herzschmerzen.
[TOC]
Nitrate Eigenschaften
Neutralität
Nitrate sind im Prinzip neutrale Substanzen wie nein3- Es ist die konjugierte Basis von Salpetersäure, HNO3, Eine starke Säure. In Wasser ist es nicht nennenswert:
NEIN3- + H2Oder ⇌ hno3 + Oh-
In der Tat kann gesagt werden, dass diese Hydrolyse überhaupt nicht auftritt-. Daher sind wässrige Nitratlösungen neutral, es sei denn, es gibt andere gelöste Substanzen.
Physikalische Erscheinungen
Anorganische Nitrate bestehen aus Salzen, deren allgemeine Formeln m sind (nein3)N, Sein N Es ist die Valencia oder positive Belastung des metallischen Kationen. Alle diese Nitrate haben kristalline Helligkeit und weiße Farben. Übergangsmetalle -Nitrate können jedoch farbenfroh sein.
Zum Beispiel Kupfernitrat (ii) oder kupfer Nitrat, Cu (nein3)2, Es ist ein bläulich kristalline Feststoff. Inzwischen Nickel Nitrat (II) noch (nein3)2, Es ist eine solide Smaragdfarbe. Einige andere Nitrate wie Eisen präsentieren schwache Farben.
Auf der anderen Seite sind organische Nitrate normalerweise hochempfindliche und explosive Feststoffe oder Feststoffe.
Es kann Ihnen dienen: LEBENS MATERE: Konzept, Merkmale und BeispieleWärmeabzersetzung
Metallnitrate sind empfindlich gegenüber hohen Temperaturen, da sie nach der folgenden chemischen Gleichung abbauen:
2m (Nr3)2(s) → 2Mo (s)+4no2(g)+oder2(G)
Wie beobachtet, zersetzt sich Metallnitrat in Oxid, MO und Stickstoff und Sauerstoffdioxid. Diese thermische Zersetzung tritt für alle Nitrate nicht bei der gleichen Temperatur auf; Einige widerstehen mehr als andere.
Je größer und kleiner die Last von Kation M ist in der Regel+, größer wird die Temperatur sein, bei der Nitrat erhitzt werden muss, um zusammenzubrechen. Stattdessen, wenn m+ Es ist klein oder hat eine große positive Belastung, zersetzt sich Nitrat bei niedrigeren Temperaturen, daher instabiler.
Zum Beispiel Natriumnitrat3, Es zersetzt3)2, Nun, obwohl der BA2+ eine größere Belastung haben als na+, Seine Größe ist viel größer.
Oxidationsmittel
Tut er nicht3- Es ist ein relativ stabiler Anion. Das Stickstoffatom ist jedoch stark oxidiert, mit einem Oxidationszustand von +5 (n)5+ENTWEDER32-), Also ist es "durstig" von Elektronen. Aus diesem Grund ist Nitrat ein Oxidationsmittel.
Es ist dieser Mangel an Elektronen im Stickstoffatom von NO3- Was der Nano macht3 Und Kno3 Starke Oxidationsmittel, die als Schießpulverkomponenten verwendet werden. Hinzu kommt die Tatsache, dass Gase freigesetzt werden2 ICH2 Beim Zersetzen versteht man sich, warum es Teil vieler Sprengstoff ist.
Wenn Nitrat Elektronen gewinnt oder sich verringert, kann es in Ammoniak umgewandelt werden, NH3, oder in Stickoxid nein, abhängig von Reagenzien und Bedingungen.
Löslichkeit
Alle anorganischen Nitrate oder was ist das gleiche Metall und Ammoniumnitrate, NH4NEIN3, Sie sind wasserlösliche Verbindungen. Dies liegt daran, dass Wassermoleküle eine starke Affinität für nicht haben3-, Und dass die kristallinen Netzwerke dieser Nitrate nicht sehr stabil sind.
Struktur
Nitratanion
 Nitratresonanzstrukturen. Quelle: Benjah-BMM27 / Public Domain.
Nitratresonanzstrukturen. Quelle: Benjah-BMM27 / Public Domain. Das obere Bild zeigt die Resonanzstrukturen des Nitratanions. Wie zu sehen ist, befinden sich zwei negative Ladungen in zwei Sauerstoffatomen, die zwischen den drei Sauerstoffatomen demokalisiert werden. Daher hat jeder oder hat eine Last von -2/3, während Stickstoff eine Last +1 hat.
Also das Nein3- Wechselwirkung elektrostatisch oder Formkoordinationsverbindungen durch eines seiner drei Sauerstoffatome.
Feststoffe
Alle anorganischen Nitrate sind Kochsalzlösung und ionisch. Daher sind seine Strukturen kristallin, was bedeutet, dass seine Ionen m+ und nicht3-, Sie sind dank ihrer elektrostatischen Wechselwirkungen im Weltraum angeordnet. Abhängig von diesen Wechselwirkungen werden ihre Kristalle unterschiedliche Strukturen aufweisen.
Kann Ihnen dienen: wofür ist der Sicherheits -Rhombus und wofür ist es??Zum Beispiel die kristalline Struktur von Nano3 Es ist trigonal oder rhomboédica, während das des KNO3 Es ist ortorrombisch.
Organische Nitrate
Organische Nitrate werden mit der allgemeinen Formel Rono vertreten2, wobei R eine Alkyl- oder aromatische Gruppe ist. Diese Verbindungen sind durch ihre R-Aon-Verbindung gekennzeichnet2, und bestehen normalerweise aus Stillbriefe von Polymeren und anderen organischen Substanzen.
Komplex
Tut er nicht3- Es koordiniert mit Metallzentren, um eine M -Verbindung zu bilden+-ODER NICHT2-, eine andere Interaktion als Ionic sein. Diese Komplexe sind im Wesentlichen anorganische Natur. Nitrat kann sogar mit zwei seiner Sauerstoffatome gleichzeitig koordiniert werden, m+-ENTWEDER2NEIN.
Nomenklatur
Um ein Nitrat zu ernennen, muss der Name des Kationen oder der Gruppe, die es in ihrer jeweiligen chemischen Formel begleitet, zuerst geschrieben werden. Die Valencia des Kation ist in Klammern angegeben, wenn es mehr als eine besitzt. Ebenso können Suffixe -Coco und -oy verwendet werden, wenn dies der Fall ist, folgt der traditionellen Nomenklatur.
Zum Beispiel den Glauben betrachten (nein3)3. Sein Name ist Eisennitrat (III), da seine Wertigkeit +3 beträgt oder auch Eisen -Nitrat genannt werden kann.
Diese Regeln gelten auch für organische Nitrate, sofern ihre Strukturen einfach sind. Zum Beispiel Cho3ODER NICHT2 Es heißt Methylnitrat, weil die -ch -Gruppe3 Es wird die R -Gruppe, die anwesend ist -anwesend2.
Ausbildung
Natürlich
Nitrate werden in der Natur als Teil des biologischen Zyklus von Stickstoff gebildet. Aus diesem Grund haben die Böden, die Meere und einige Wasserströmungen erhebliche Mengen an Nitraten. Abhängig von den umgebenden Ionen werden verschiedene Nitrate -Salze gebildet, da Nano ist3 Und Kno3 Die häufigsten und reichlichsten.
Industriell
Nitrate werden in Industriegrößen durch Neutralisation von Salpetersäure gebildet, entweder mit Metallhydroxiden, Alkoholen, Polymeren usw. Zum Beispiel Calciumnitrat, CA (Nein3)2, Es kann gemäß der folgenden chemischen Gleichung hergestellt werden:
CA (OH)2 + 2HNO3 → CA (nein3)2 + 2H2ENTWEDER
In ähnlicher Weise werden mehrere organische Substanzen von HNO angegriffen3 unter bestimmten Bedingungen, um den Ersatz einiger ihrer Gruppen durch -ano zu fördern2. Dies geschieht mit der Reaktion von Cellulose, um sich in Nitrocellulose- oder Cellulose -Nitrat zu verwandeln, ein polymeres und explosives Material.
Photokatalytisch
Der Anion Nr3-, Und daher können anorganische Nitrate durch die photokatalytische Wirkung von Titanoxidabfällen, Onkel, gebildet werden2, Verwenden Sie als Rohstoff nichts anderes als Stickstoff und Luftsauerstoff. Diese Studie geht davon aus2, Es wird unerwünschte Mengen von Nein geben3-, die die Wassertopfbarkeit beeinflussen und Algen umfassen können.
Kann Ihnen dienen: AldehydosAnwendungen
Fleischhärtung
 Die Würste sind eines der verarbeiteten Fleischs, die mehr Nitrate enthalten. Quelle: pxhere.
Die Würste sind eines der verarbeiteten Fleischs, die mehr Nitrate enthalten. Quelle: pxhere. Zu mehreren Fleisch, insbesondere Wurst, werden Nitrate hinzugefügt, um Bakterien zu beseitigen und damit ihre Verschlechterung zu verzögern. Sie reagieren auch mit ihren Proteinen, um ihnen eine rötlichere Farbe zu geben. Das Problem dieses Fleisches ist, dass sie durch Kochen bei hohen Temperaturen Nitrosoamine produzieren: Verbindungen, die mit Dickdarmkrebs verbunden sind.
Diese Reaktion wird teilweise vermieden, wenn es Vitamine gibt.
Landwirtschaft
Nitrate sind eine lösliche Stickstoffquelle. Daher dient es als Dünger, um Stickstoff zu Pflanzen beizutragen und damit ihr Wachstum zu bevorzugen.
Medizin
Nitrate haben eine besondere Funktion im Körper. Bei der Assimilation durch enzymatische Wirkung wird es auf Stickoxid reduziert, nein. Dieses Molekül nimmt Volumen ein und erweitert Venen und Arterien, sodass es einen größeren Blutfluss geben kann. Daher werden Nitrate als Medikamente zur Bekämpfung des Kreislaufsystems verwendet.
Ironisch und merkwürdig, zu diesem Zweck organische Nitrate wie Glycerin, Nitroglycerin, isosorbides Mononitrat und Pentaerithrit -Tetranitrat wurden verwendet, alle guten Kandidaten in der Welt des Sprengstoffes.
Sprengstoff
Nitrate werden in explosiven Formulierungen verwendet, wobei der Schießpulver das symbolischste Beispiel ist. Oxidierende Wirkstoffe bevorzugen die Verbrennung der Materie, zusätzlich zu der abrupten Ausdehnung des Volumens aufgrund ihrer Freisetzung von Gasen nach dem Zerlegen.
Beispiele für Nitrate
In den vorherigen Abschnitten wurden mehr als ein Beispiel für Nitrate erwähnt. Schließlich werden einige andere zusammen mit ihren jeweiligen Formeln und Namen aufgeführt:
-Leinen3: Lithiumnitrat
-Rbno3: Rubidio Nitrat
-Mg (nein3)2: Magnesiumnitrat
-SC (Nr3)2: Scandio nitrat
-Cr (nein3)3: Chromnitrat (III)
-Zn (nein3)2: Zinknitrat
-Pb (nein3)2: Bleinitrat (ii)
-Agno3: Silbernitrat
-CH3CH2ODER NICHT2: Ethylnitrat
-CH3(CH2)4ODER NICHT2: Amilo Nitrat
Verweise
- Shiver & Atkins. (2008). Anorganische Chemie. (Vierte Edition). Mc Graw Hill.
- Carey f. (2008). Organische Chemie. (Sechste Ausgabe). Mc Graw Hill.
- Clark j. (5. Juni 2019). Die thermische Stabilität der Nitrate und Carbonate. Chemistry Librettexts. Erholt von: Chem.Librettexts.Org
- Wikipedia. (2020). Nitrat. Abgerufen von: in.Wikipedia.Org
- Angela Dowden. (12. März 2019). Die Wahrheit über die Nitrate in Ihrem Essen. Abgerufen von: BBC.com
- Elsevier b.V. (2020). Nitrat. Scientedirect. Abgerufen von: Scientedirect.com
- DR. Biji s. & Prof. Govindan v. (26. April 2017). Die Rolle organischer Nitrate bei der optimalen medizinischen Behandlung von Angina. Europäische Gesellschaft für Kardiologie. Erholt von: Escardio.Org
- Yuan, s., Chen, j., Lin, z. et al. (2013). Nitratbildung aus atmosphärischem Stickstoff und Sauerstoff photokatalien. Nat Commun 4, 2249. doi.org/10.1038/ncomms3249
- « Erzähltherapie Grundlagen von Michael White, Verfahren, Techniken
- Epoxy -Nomenklatur, erhalten, Anwendungen, Beispiele »

