Nitrileigenschaften, Nomenklatur, Verwendungen, Beispiele

- 3316
- 814
- Frederike Birkemeyer
Der Nitrile Es sind all jener organischen Verbindungen, die die CN -Funktionsgruppe haben, die auch als Cyano -Gruppe oder Cyanid in Bezug auf die anorganische Chemie bezeichnet wird. Aliphatische Nitrile werden mit der RCN -allgemeinen Formel dargestellt, während aromatische Nitrile mit der Bogenformel.
Obwohl Wasserstoff Cyanid, HCN und Cyanidmetallsalze hochgiftige Verbindungen sind, tritt genau das gleiche bei Nitrilen nicht auf. Die CN -Gruppe in einem Kohlenstoffskelett jeglicher Art (verzweigt, linear, aromatisch usw.), es verhält sich diagonal von einem Cyanidanion, CN, unterscheidet-.
 Allgemeine Formel für einen aliphatischen Nitril. Quelle: Benjah-BMM27 über Wikipedia.
Allgemeine Formel für einen aliphatischen Nitril. Quelle: Benjah-BMM27 über Wikipedia. Nitrile sind in der Welt der Kunststoffe sehr verbreitet, wie einige von ihnen aus Acrilonitrile, Ch2CHCN, ein Nitril, mit dem Polymere synthetisiert werden, wie z. Nitrile sind auch in vielen natürlichen und pharmazeutischen Produkten vorhanden.
Andererseits sind Nitrile Vorläufer von Carboxsäuren, da ihre Hydrolyse eine alternative Synthesemethode darstellt.
[TOC]
Eigenschaften und Eigenschaften
Struktur
Die molekularen Strukturen der Nitrile variieren je nach Identität von R oder AR in den RCN- oder ARCN -Verbindungen.
Die CN -Gruppengeometrie ist jedoch aufgrund ihrer dreifachen Verbindung, C≡N, linear, die das Produkt der SP -Hybridisierung ist. Somit befinden sich C-Cwerb-Atome in derselben Linie. Über diese Atome hinaus kann es jede Struktur geben.
Polarität
Nitrile sind polare Verbindungen, da Stickstoff der CN -Gruppe sehr elektronegativ ist und Elektronen zu sich selbst anzieht. Daher haben sie Fusions- oder Siedepunkte, die höher sind als ihre Homologen.
Es kann Ihnen dienen: Scandio: Geschichte, Eigenschaften, Reaktionen, Risiken und VerwendungZum Beispiel Acetonitril, Cho3CN, es ist eine Flüssigkeit, die bei 82 ° C kocht; Während ETANO, CH3CH3, Es ist ein Gas, das bei -89 ºC kocht. Beachten Sie den großen Effekt, den die CN -Gruppe auf intermolekulare Wechselwirkungen hat.
Die gleiche Argumentation gilt für größere Verbindungen: Wenn sie eine oder mehrere CN -Gruppen in ihrer Struktur haben, ist es sehr wahrscheinlich, dass ihre Polarität zunimmt und mehr mit Oberflächen oder polaren Flüssigkeiten zusammenhängt.
Basizität
Es könnte vermutet werden, dass dies aufgrund der hohen Polarität von Nitrilen relativ starke Grundlagen vor den Aminen sind. Wir müssen jedoch die kovalenten C & N -Bindungen in Betracht ziehen und die Tatsache, dass sowohl Kohlenstoff als auch Wasserstoff SP -Hybridisierung haben.
Die Basizität des RCN: Es wird dargestellt, indem ein Proton aus dem Wasser angenommen wird: Wasser:
Rcn: + h2Oder ⇌ rcnh+ + Oh-
Zum Protonieren des RCN: Das elektronenfreie Drehmoment des Stickstoffs muss eine Verbindung mit dem Ion H bilden+. Aber es gibt Unannehmlichkeiten: Stickstoffhybridisierung macht sie zu elektronegativ, so sehr, dass dieses Elektronenpaar sehr stark angezogen wird und nicht einmal eine Bindung bildet.
Daher wird gesagt, dass das Stickstoff -Sper -Stickstoffpaar nicht verfügbar ist und dass die Basizität von Nitrilen sehr niedrig ist. Tatsächlich sind Nitrile Millionen von Zeiten weniger grundlegend als Amine.
Reaktivität
Unter den repräsentativsten Reaktionen von Nitrilen haben wir ihre Hydrolyse und Reduzierung. Diese Hydrolyse wird durch die Säure oder Basizität der wässrigen Umgebung vermittelt, wodurch eine Carboxylsäure bzw. ein Carboxylatsalz verursacht wird:
Kann Ihnen dienen: Flüssigkeits-DampfbalanceRCN + 2H2O + hcl → rcooh + nh4Cl
RCN + H2O + naOH → rcona + nh3
Dabei wird auch ein Amida gebildet.
Nitrile werden unter Verwendung von Wasserstoff- und Metallkatalysatoren auf Amine reduziert:
RCN → RCH2NH2
Nomenklatur
Nach der IUPAC -Nomenklatur werden Nitrile durch Hinzufügen des Suffix -Nitrils zum Namen der Alkanekette benannt, aus der es abgeleitet ist, einschließlich des Kohlenstoffs des Cyano. So, Cho3CN heißt Ethanonitrilo und Cho3CH2CH2CN, Butanonitril.
Sie können auch aus dem Namen Carboxylsäure ernannt werden, das durch das Wort "Säure" beseitigt wird, und die Suffixe werden durch das Suffix -anitril ersetzt. Zum Beispiel für CH3CN wäre Acetonitril (Essigsäure); Für c6H5CN, es wäre Benzonitril (von Benzoesäure); Und für ihn (Cho3)2CHCN, 2-Methylpropanitril.
Wenn die Namen von Alquilician -Substituenten in Betracht gezogen werden, können Nitrile unter Verwendung des Wortes 'Cyanid' erwähnt werden. Zum Beispiel Cho3CN würde dann Methylcyanid genannt, und (Cho3)2CHCN, Isopropylcyanid.
Anwendungen
Nitrile sind Teil der Naturprodukte, die sich in bitteren Mandeln, in den Knochen verschiedener Früchte, in Meerestieren, Pflanzen und Bakterien befinden.
Seine CN -Gruppen bilden die Strukturen von cyanogenen Lipiden und Glykosiden, Biomoleküle, die bei abgebautem Abbau Wasserstoff Cyanid, HCN, ein hoch giftiges Gas. Daher haben sie eine bevorstehende biologische Verwendung für bestimmte Kreaturen.
Es wurde zuvor gesagt, dass CN -Gruppen den Molekülen viel Polarität verleihen und tatsächlich nicht unbemerkt bleiben, wenn sie in Verbindungen mit pharmakologischer Aktivität vorhanden sind. Solche nitrilen Medikamente wurden verwendet, um Hyperglykämie, Brustkrebs, Diabetes, Psychose, Depression und andere Störungen zu bekämpfen.
Kann Ihnen dienen: Irreversible Reaktion: Merkmale und BeispieleZusätzlich zur Rolle in Biologie und Medizin bilden sie industriell eine Handvoll Nitril -Kunststoffe, mit denen chirurgische und Laborhandschuhe hergestellt werden, Stempel von Automobilteilen, Schläuchen und Gelenke aufgrund ihres Widerstands gegen Korrosion und Fettsäuren, Materialien wie Tupperware, Musikinstrumente oder Legosblöcke.
Nitrile Beispiele
Als nächstes werden einige Beispiele für Nitrile aufgeführt.
Nitril -Gummi
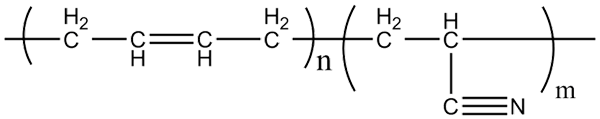 Molekülstruktur von Akrilonitril-Butadien-Copolymeren. Quelle: Klever über Wikipedia.
Molekülstruktur von Akrilonitril-Butadien-Copolymeren. Quelle: Klever über Wikipedia. Nitril -Gummi, mit dem die oben genannten Handschuhe und fettresistenten Materialien hergestellt werden, ist ein Copolymer, das durch Acrilonitril und Butadiene (oben) gebildet wird. Beachten Sie, wie linear die CN -Gruppe aussieht.
Ciamemazin
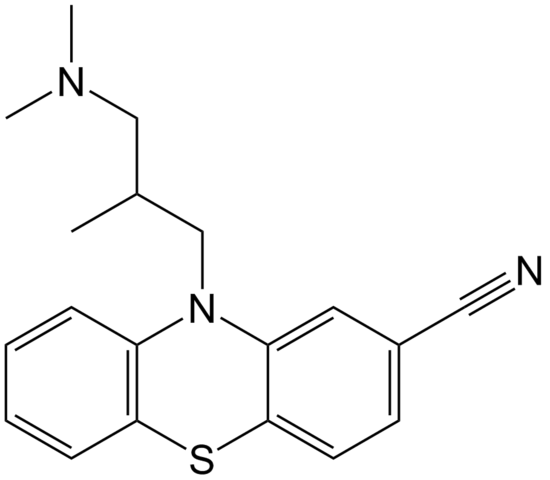 Molekülstruktur von Cipemazin. Quelle: Epop / Pub -Domäne
Molekülstruktur von Cipemazin. Quelle: Epop / Pub -Domäne Cyammazin ist ein Beispiel für ein Nitril im Apothekenbereich, das als antipsychotisch verwendet wird, insbesondere zur Behandlung von Angstzuständen und Schizophrenie -Störungen. Beachten Sie erneut die Linearität der CN -Gruppe.
Citalopram
 Ein anderes nitriles Medikament ist Citalopram, das als Antidepressivum verwendet wird
Ein anderes nitriles Medikament ist Citalopram, das als Antidepressivum verwendet wird Amygdalin
 Molekülstruktur des Mandels. Quelle: Wesalius / Public Domain
Molekülstruktur des Mandels. Quelle: Wesalius / Public Domain Der Mandel ist ein Beispiel für einen cyanogenen Glucóside. Es ist in bitteren Mandeln, Pflaumen, Aprikosen und Pfirsichen zu finden. Beachten Sie, wie klein die CN -Gruppe in Bezug auf den Rest der Struktur aussieht. Trotzdem reicht seine einzelne Präsenz aus, um diesem Kohlenhydraten eine einzigartige chemische Identität zu bieten.
Verweise
- Graham Solomons t.W., Craig b. Braten. (2011). Organische Chemie. (10th Auflage.). Wiley Plus.
- Carey f. (2008). Organische Chemie. (Sechste Ausgabe). Mc Graw Hill.
- Morrison und Boyd. (1987). Organische Chemie. (Fünfte Ausgabe). Addison-Wesley Iberoamericana.
- Wikipedia. (2020). Nitril. Abgerufen von: in.Wikipedia.Org
- Chemistry Librettexts. (5. Juni 2019). Chemie von Nitrilen. Erholt von: Chem.Librettexts.Org
- Jim Clark. (2016). Hydrolysing -Nitrile. Erholt von: Chemguide.CO.Vereinigtes Königreich
- Ivy Rose ganzheitlich. (2020). Nitril -Benennung. Abgerufen von: ivyrose.com
- Germán Fernández. (S.F.). Nitril -Nomenklatur: IUPAC -Regeln. Erholt von: Chemicicaorganica.Org

