Kaliumnitrit (KNO2) -Struktur, Eigenschaften und Verwendung

- 921
- 142
- Joe Hartwig
Er Kaliumnitrit Es ist ein anorganisches Salz, dessen chemische Formel wie ist2, das ist chemisch und pharmakologisch mit Kaliumnitrat verwandt3. Sein physisches Erscheinungsbild besteht aus gelblichen weißen Kristallen, hoch hygroskopisch und damit Delagen; Das heißt, sie lösen sich in feuchten Umgebungen schnell auf.
Seine Formel zeigt an, dass der Anteil der K -Ionen+ und nicht2- Es ist 1: 1 und bleibt durch elektrostatische Kräfte oder durch ionische Verbindungen vereint. Reine natürliche Quellen haben offenbar nicht für ihre Kristalle gefunden, obwohl Niter -Anionen in Böden, Düngemitteln, Pflanzen und Tieren gefunden werden können.
 Kalium -Nitalkristalle. Quelle: Leiem [CC BY-SA 4.0 (https: // creativecommons.Org/lizenzen/by-sa/4.0)]]
Kalium -Nitalkristalle. Quelle: Leiem [CC BY-SA 4.0 (https: // creativecommons.Org/lizenzen/by-sa/4.0)]] Das obere Bild zeigt, wie die Kristalle von Kno aussehen2, Mit ausgeprägten gelben Tönen. Wenn diese Kristalle mit der Luft in Kontakt bleiben, absorbieren sie Feuchtigkeit, um eine wässrige Lösung zu werden. Lösung, die Kontroversen in Bezug darauf erzeugt hat, ob ihre Verwendung von Vorteil ist oder nicht.
Andererseits werden seine Kristalle unter sehr kleinen Mengen (200 ppm) verwendet, um Fleisch zu salinieren und ihre Erhaltung gegen Bakterienwirkung zu garantieren. Auch das KNO2 Verbessert die Farbe des Fleisches und dreht sie rötlicher; Es unterliegt jedoch mehreren Einschränkungen, um die toxischen Wirkungen dieses Salzes auf den Körper zu vermeiden.
[TOC]
Kaliumnitritstruktur
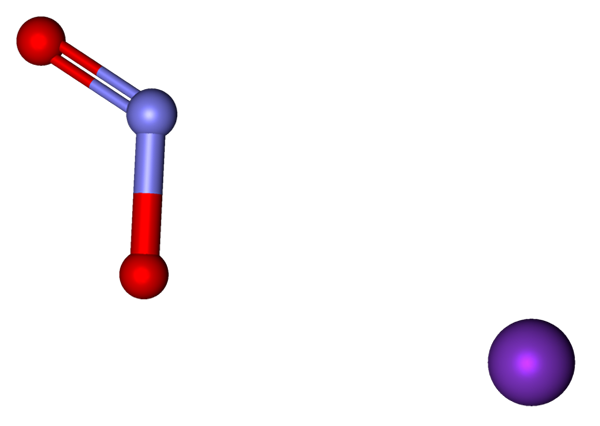 Ionen, aus denen das KNO2 mit einem Modell von Kugeln und Stäben dargestellt wird. Quelle: Marinavladivok [CC0].
Ionen, aus denen das KNO2 mit einem Modell von Kugeln und Stäben dargestellt wird. Quelle: Marinavladivok [CC0]. Die im Kaliumnitrit vorhandenen Ionen sind oben gezeigt. Das Kation k+ entspricht der lila Sphäre, während der Anion nicht tut2- Es wird durch die bläulichen und roten Kugeln dargestellt.
Der Anion Nr2- Es wird mit einer doppelten und einer einfachen [o = n-o] gezeigt-; In Wirklichkeit sind beide Verbindungen aufgrund der Resonanz der negativen Last zwischen ihnen gleich.
Die K Ionen+ und nicht2- Sie ziehen sich im Raum an, um ein strukturelles Muster mit der geringsten Energie zu organisieren. Dies ist, wenn die Abstoßungen zwischen den gleichen Lasten minimal sind. Und so glauben die KNO -Kristalle2, deren Einheitszelle ist anfällig für Temperaturänderungen, welche Phasenübergänge übergehen.
Kann Ihnen dienen: Stanislao CannizzaroZum Beispiel bei niedrigen Temperaturen (weniger als 25 ° C) die KNO -Kristalle2 ein monoklines System annehmen (Phase I). Wenn die Temperatur 25 ° C überschreitet, tritt ein rhomboébischer monokliner Phasenübergang auf (Phase II). Schließlich über 40 ° C die KNO -Kristalle2 Änderung kubisch sein (Phase III).
Auch das KNO2 kann andere kristalline Phasen (Phasen IV, V und VI) unter hohen Drücken aufweisen. Damit k Ionen+ und nicht2- Sie bewegen sich in unterschiedlichen Kristallen auf unterschiedliche Weise auf unterschiedliche Weise.
Eigenschaften
Molekulare Masse
85.1038 g/mol.
Dichte
1.9150 g/ml.
Schmelzpunkt
440,02 ° C (beginnt jedoch von 350 ° C abzubauen, wobei toxische Dämpfe emittiert werden).
Siedepunkt
537 ° C (Explosion).
Wasserlöslichkeit
312 g/ 100 g Wasser bei 25 ° C.
Zartung
Seine Löslichkeit im Wasser ist so, dass sie hygroskopisch ist; so sehr, dass das Delikowenz aufweist und ausreichende Feuchtigkeit zum Auflösen absorbiert. Diese Affinität zum Wasser kann auf die Energiestabilität zurückzuführen sein, die Kionen gewinnen+ Bei der Feuchtigkeit sowie bei einer niedrigen kristallinen Netzwerkenthalpie für die KNO -Kristalle2.
Kristalle können Wasser absorbieren, ohne sich aufzulösen, um ein Hydrat zu werden2· H2ENTWEDER. In Hydrat begleitet das Wassermolekül die Ionen, was die kristalline Struktur modifiziert.
Dieses Hydrat (oder einige von ihnen) kann unter -9 ° C gebildet werden; Bei einer höheren Temperatur löst sich Wasser auf und hydriert die Ionen und deformiert das Glas.
Löslichkeit in anderen Lösungsmitteln
Leicht löslich in heißen Alkoholen und in Ammoniak sehr löslich.
pH
6-9. Seine wässrigen Lösungen sind daher alkalisch, da das Anion dies nicht tut2- Es kann hydrolyisieren.
Nomenklatur
Zu kno2 Es kann auch auf andere Weise benannt werden. 'Kaliumnitrit' entspricht dem Namen für dieses Salz gemäß der Aktiennomenklatur; "Kaliumnitrito" nach der systematischen Nomenklatur, in der die einzige Valenz von Kalium, +1 hervorgehoben wird; und Dioxonitrat (III) von Kalium gemäß der systematischen Nomenklatur.
Es kann Ihnen dienen: Dibenzalacetona: Eigenschaften, Reaktionsmechanismus, Anwendungen, RisikenKalium 'Dioxonitrat (III), hervorhebt die Valenz +3 des Stickstoffatoms. Sogar der Name, den der IUPAC für den KNO am meisten empfohlen hat2, "Kaliumnitrit" ist weiterhin am bequemsten und am einfachsten zu erinnern.
Erhalten
Der direkteste Weg, um es zu synthetisieren, aber mit geringerer Leistung ist die thermische Zersetzung von Kaliumnitrat oder Salzträumen bei 400 ° C oder mehr:
2kno3 => Kno2 + ENTWEDER2
Allerdings ein Teil des KNO2 endet zusätzlich zu anderen Produkten durch Hitze durch Hitze.
Eine andere Methode zur Vorbereitung oder Synthese mit höherer Leistung besteht darin, den KNO zu reduzieren3 In Gegenwart von Blei, Kupfer oder Zink. Die Gleichung für diese Reaktion lautet wie folgt:
Kno3 + Pb => Kno2 + Pbo
Kalium und Bleinitrat sind in einer Eisenpfanne stöchiometrisch gemischt, wo sie eine halbe Stunde lang mit konstanter Bewegung und Erwärmung verschmelzen. Bleioxid (II) ist gelb und der resultierende Teig ist heiß und mit kochendem Wasser behandelt. Dann filtert die heiße Mischung.
Die heißen Filterblasen blasen fünf Minuten mit Kohlendioxid, was Blei -Carbonat, PBCO ausfällt3, unlöslich. Auf diese Weise ist die Führung der Führung beendet. Die zum Filtern verdünnte Salpetersäure wird zugesetzt, bis der pH -Wert neutral ist, es abkühlen darf, und schließlich verdampft das Wasser, so dass die Kristalle von Kno gebildet werden2.
Anwendungen
Additiv und Reagenz
Kaliumnitrit wird als Additiv für heilige rot. Daher zeigt es eine antibakterielle Wirkung.
Der Kno2 Es oxidiert nicht, was mit Myoglobin des Fleisches reagiert und folglich seine natürliche rote Farbe modifiziert. Wenn das Fleisch gekocht wird, erhält es seine charakteristische starke rosa Farbe.
Kann Ihnen dienen: 20 Beispiele für chemische Sublimation und EigenschaftenUnter Bedingungen ohne Angabe des KNO2 reagiert mit Fleischproteinen, um Nitrosamin zu führen, was krebserregend werden kann.
Andererseits das KNO2 (obwohl vorzugsweise Nano2) Es ist ein analytisches Reagenz, das bei der Synthese von azoischen Farbstoffen (die Reaktion von Liegensäure mit aromatischen Aminen) und in der Aminosäureanalyse verwendet werden kann.
Gegenmittel
Während es seine negativen Effekte hat, KNO2 Es wirkt als Gegenmittel bei vergifteten Patienten mit Cyaniden und Wasserstoffsulfid. Sein Mechanismus ist es, die Zentren des Glaubens zu oxidieren2+ zum Glauben3+ von den Gruppen, die wir von den Hämoglobinen haben und Methämoglobin produzieren, das dann mit den CN -Anionen reagiert- und hs-.
Ärzte
Im Magensaft des Magens tut das Anion nicht2- Es wird auf Nichts reduziert, was bekanntermaßen vasodilatatorische Wirkung hat, wodurch der Blutfluss erhöht wird. In anderen Regionen des Körpers, in denen der pH nicht genug Säure ist, sind einige Enzyme, wie z2-.
KNO wurde verwendet2 Behandlung und Krankheiten wie Brustangina und Epilepsie (mit sehr negativen Nebenwirkungen) zu behandeln (mit sehr negativen Nebenwirkungen).
Verweise
- Wikipedia. (2019). Kaliumnitrit. Abgerufen von: in.Wikipedia.Org
- Prebchem. (2016). Vorbereitung Kaliumnitrit. Erholt von: Primchem.com
- Mark Gilchrist, Angela C. Ufer, Nigel Benjamin. (2011). Anorganischer Nitrat und Nitrit und Kontrolle des Blutdrucks, Herz-Kreislauf-Forschung, Band 89, Ausgabe 3, 15. Februar 2011, Seiten 492-498, doi.org/10.1093/CVR/CVQ309
- Pubchem. (2019). Kaliumnitrit. Erholt von: Pubchem.NCBI.NLM.NIH.Regierung
- Chemische Formulierung. (2018). Kaliumnitrit. Wiederhergestellt von: Quimica -Formulierung.com
- Nationales Zentrum für die Weiterentwicklung von Übersetzungswissenschaften. (2011). Kaliumnitrit. Erholt von: Drogen.NCATs.Io
- Richard J. Eley, Paul B. Addis und Joseph J. Wartheen. (1992). Nitrit in Fleisch. Universität von Minnesota.
- N. R. Rao, b. Prakash und m. Natarajan. (1975). Kristallstrukturtransformationen in anorganischen Nitriten, Nitraten und Carbonaten. Abteilung für Chemie, Indian Institute of Technology, Kanpur, Indien.
- « Politische Sprachmerkmale, Typen, Themen und Beispiele
- Müllverschmutzung verursacht Ursachen, Folgen und Beispiele »

