Nitrobenzol (C6H5NO2) -Struktur, Eigenschaften, Verwendungen, Risiken

- 2793
- 192
- Luca Holdt
Er Nitrobenzol Es ist eine aromatische organische Verbindung, die von einem Benzenischen Ring C gebildet wird6H5- Und eine Nitro -No -Gruppe2. Seine chemische Formel ist c6H5NEIN2. Es ist eine bunte oder hellgelbe ölige Flüssigkeit mit einem Geruch von bitteren Mandeln oder Schuhen für Schuhe.
Nitobenzol ist eine sehr nützliche Verbindung in der chemischen Industrie, da sie eine Reihe von chemischen Substanzen erhalten kann, die die Verwendungen variiert haben. Dies liegt daran, dass es verschiedenen Arten von Reaktionen ausgesetzt sein kann.
 Nitrobencene, c6H5-NEIN2. Autor: Marilú Stea.
Nitrobencene, c6H5-NEIN2. Autor: Marilú Stea. Zu den wichtigen chemischen Reaktionen gehören die Nitrierung (sodass Sie weitere Gruppen hinzufügen können2 zum Molekül) und die Reduktion (das Gegenteil der Oxidation, da die beiden Sauerstoffatome der Nitrogruppe -Nr2 und werden durch Hydrogene ersetzt).
Mit Nitrobencen können Sie zum Beispiel Anilin und Para-Acetaminophenol vorbereiten. Letzteres ist das gut bekannte Paracetamol, das ein Antipyretiker (Fiebermedikament) und weiche Analgetika (kleines Schmerzmittel) ist.
Nitobenzol muss mit Vorsicht manipuliert werden. Es ist auch schädlich für die Umwelt.
[TOC]
Struktur
Das Nitrobenzol c6H5-NEIN2 Es ist ein flaches Molekül, das von einem Benzenischen Ring c gebildet wird6H5- mit der eine Nitro -Gruppe verknüpft ist -NOT2. Sein Molekül ist flach, da zwischen der Nitro -No -Gruppe eine elektronische Wechselwirkung besteht2 und der Benzolring.
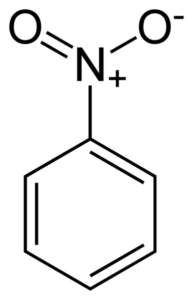 Flache Struktur des Nitrobenzolmoleküls. Die Elektronen der doppelten Bondyan -Ringverbindungen tendieren dazu, mit der Nitro -No -Gruppe zu interagieren2. Autor: Benjah-BMM27. Quelle: Wikimedia Commons.
Flache Struktur des Nitrobenzolmoleküls. Die Elektronen der doppelten Bondyan -Ringverbindungen tendieren dazu, mit der Nitro -No -Gruppe zu interagieren2. Autor: Benjah-BMM27. Quelle: Wikimedia Commons. Die nitro -no -Gruppe2 zieht die Elektronen des Benzenischen Rings C an6H5-.
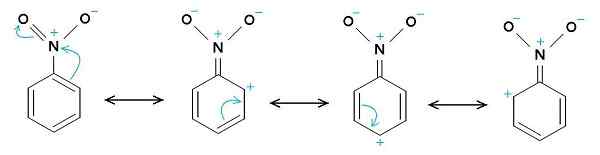 Nitrobenzol -Resonanzstrukturen. Der Benzolring hat tendenziell eine positive Belastung, während die Nitro -NO2 -Gruppe tendenziell eine negative Belastung aufweist. Der ursprüngliche Uploader war Samuele Madini bei italienischen Wikipedia. [Public Domain]. Quelle: Wikimedia Commons.
Nitrobenzol -Resonanzstrukturen. Der Benzolring hat tendenziell eine positive Belastung, während die Nitro -NO2 -Gruppe tendenziell eine negative Belastung aufweist. Der ursprüngliche Uploader war Samuele Madini bei italienischen Wikipedia. [Public Domain]. Quelle: Wikimedia Commons. Deshalb hat das Molekül eine etwas negativere Seite (wo der Sauerstoff von -no ist2) und eine etwas positivere Seite (der Benzolring).
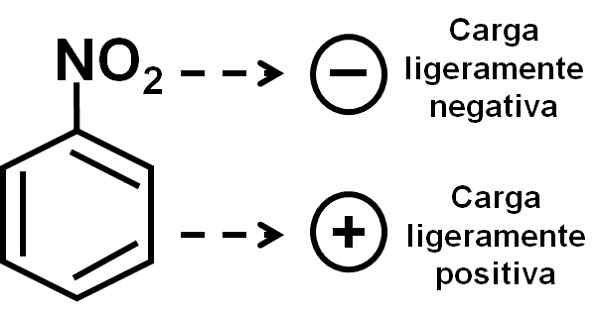 Der Sauerstoff der Nitrogruppe hat im Vergleich zum Benzinischen Ring eine leicht negative Belastung. Autor: Marilú Stea.
Der Sauerstoff der Nitrogruppe hat im Vergleich zum Benzinischen Ring eine leicht negative Belastung. Autor: Marilú Stea. Nomenklatur
- Nitrobenzol.
- Nitrobenze.
- Nitrobenzol.
- Öl oder Essenz von Mirbano oder Mirbana (stillgelegter Begriff).
Eigenschaften
Körperlicher Status
Farbenfrohe ölige Flüssigkeit zu hellgelb.
Molekulargewicht
123.11 g/mol.
Schmelzpunkt
5.7 ºC.
Siedepunkt
211 ºC.
Es kann Ihnen dienen: Kobaltchlorid (COCL2 (: Struktur, Nomenklatur, EigenschaftenFlammpunkt
88 ºC (Methode für geschlossene Tassen).
Selbstdirektionstemperatur
480 ° C.
Dichte
1.2037 g/cm3 bei 20 ºC.
Löslichkeit
Little wasserlöslich: 0,19 g/100 g Wasser bei 20 ° C. Vollständig mit Alkohol, Benzol und Dietyl Ether mischbar.
Chemische Eigenschaften
Nitrobencen ist bis zu einer Temperatur von ungefähr 450 ° C stabil, bei der es sich zu zersetzen beginnt (in Abwesenheit von Sauerstoff) nein, nein2, Benzol, Biphenyl, Anilin, Dibenzofurano und Naphthalin.
Unter den wichtigen Reaktionen von Nitrobencen sind Reduktion, Nitrierung, Halogenierung und Sulfonation.
Die Nitrobenzolnitrierung produziert zunächst Meta-Nitrobenzol und mit einer langen Reaktion wird 1,3,5-Nitobenzol erhalten.
Reaktionsbrom- oder Chlor mit Nitrobenzol in Gegenwart eines geeigneten Katalysators wird 3-Brom-Nitrobenzol (Meta-Bromonitrobencen) oder 3-Clor-Nitrobenzol (Meta-Lloronitrobenzol) erhalten.
Ein Beispiel für die Reduktion ist, dass bei der Behandlung mit Tin (SN) in Salzsäure (HCl) die meta-Halogenonitobenzolen durch die Meta-Halogenoanyline erhalten werden.
Die Sulfonierung von Nitrobenzol wird mit Raucherschwefelsäure bei 70-80 ° C durchgeführt und das Produkt ist meta-nitrobenzulfonische Meta-Nitrobenze. Dies kann mit Eisen und HCl reduziert werden, um Methanylsäure zu ergeben.
Dimmer -Bildung
In einer Benzollösung c6H6 Nitrobencen -Moleküle sind miteinander verbunden. In diesen Paaren befindet sich eines der Moleküle in einer umgekehrten Position in Bezug auf den anderen.
Die Bildung von Nitrobenzol -Durchmessern mit Molekülen in einer umgekehrten Position in Bezug auf die andere ist möglicherweise darauf zurückzuführen.
Im Dimer befindet sich die Seite mit etwas mehr positiver Belastung eines der Moleküle möglicherweise nahe der etwas negativen Belastung des anderen Moleküls.
 Nitrobencen -Zahl, dh zwei Moleküle, die in einigen Lösungsmitteln zusammen sind. Autor: Marilú Stea.
Nitrobencen -Zahl, dh zwei Moleküle, die in einigen Lösungsmitteln zusammen sind. Autor: Marilú Stea. Andere Eigenschaften
Es präsentiert einen Geruch ähnlich wie Mandeln oder nach Schuhen polieren. Durch die Senkung ihrer Festigkeit der Temperatur in Form grünlich gelber Kristalle.
Erhalten
Sie behandeln die Benzol C6H6 Mit einer Mischung aus Salpetersäure hno3 und Schwefelsäure H2SW4. Der Prozess wird als Nitration bezeichnet und beinhaltet die Bildung des Nitroniumions nicht2+ Dank des Vorhandenseins von Schwefelsäure H2SW4.
- Nitronio Ion Nr2+:
Hno3 + 2 h2SW4 ⇔ h3ENTWEDER+ + 2 HSO4- + NEIN2+ (Nitronio Ion)
- Der Nitronio -Ion greift Benzol an:
Kann Ihnen dienen: systematischer Fehler: Wie berechnet man es, in der Chemie, in Physik, BeispieleC6H6 + NEIN2+ → c6H6NEIN2+
- Nitrobencene wird gebildet:
C6H6NEIN2+ + HSO4- → c6H5NEIN2 + H2SW4
In Summe:
C6H6 + Hno3 → c6H5NEIN2 + H2ENTWEDER
Die Benzolnitrierungsreaktion ist sehr exotherm, dh sehr Wärme erzeugt, daher ist sie sehr gefährlich.
Anwendungen
Bei der Erlangung von Anilin und Paracetamol
Nitrobencene wird hauptsächlich zur Synthese von Anilin C verwendet6H5NH2, Das ist eine weit verbreitete Verbindung zur Herstellung von Pestiziden, Zahnfleisch, Farbstoffen, Sprengstoff und Medikamenten.
Das Erhalten von Anilin erfolgt durch Reduzieren von Nitrobenzol in saurem Medium in Gegenwart von Eisen oder Zinn, das gemäß den folgenden Schritten durchgeführt wird:
Nitrobenzol → Nitrobenzol → Phenylhydroxylamin → Anilin
C6H5NEIN2 → c6H5Nein → c6H5Nhoh → c6H5NH2
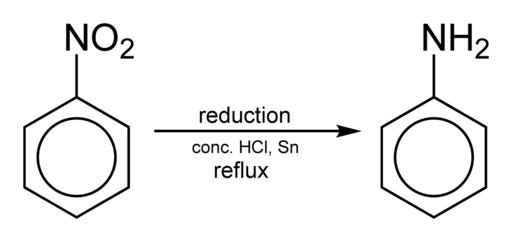 Nitrobencen -Reduktion, um Anilin zu erhalten. Benjah-BMM27 [Public Domain]. Quelle: Wikimedia Commons.
Nitrobencen -Reduktion, um Anilin zu erhalten. Benjah-BMM27 [Public Domain]. Quelle: Wikimedia Commons. Abhängig von den Bedingungen kann der Prozess in einem der Zwischenschritte in Phenylhydroxylamin gestoppt werden. Ab Phenylhydroxylamin in einer stark sauren Umgebung kann Para-Aminophenol hergestellt werden:
Phenylhdroxylamin → P-Aminophenol
C6H5Nhoh → hoc6H4NH2
Letzteres wird mit Essigsäureanhydrid behandelt, um Paracetamol (Paracetamol) zu erhalten.
 Manchmal ist es möglich, Kinder mit Fieber mit Paracetamol zu medikamentieren. Paracetamol ist ein Nitrobenzolderivat. Autor: Augusto Ordonez. Quelle: Pixabay.
Manchmal ist es möglich, Kinder mit Fieber mit Paracetamol zu medikamentieren. Paracetamol ist ein Nitrobenzolderivat. Autor: Augusto Ordonez. Quelle: Pixabay.  Paracetamolpillen, ein Nitrobenzolderivat. Paracetamol_acetaminophen_500_mg_pils.JPG: Michelle Tribe aus Ottawa, Canadaderivative Arbeit: Anrie [CC BY.Org/lizenzen/bis/3.0)]]. Quelle: Wikimedia Commons.
Paracetamolpillen, ein Nitrobenzolderivat. Paracetamol_acetaminophen_500_mg_pils.JPG: Michelle Tribe aus Ottawa, Canadaderivative Arbeit: Anrie [CC BY.Org/lizenzen/bis/3.0)]]. Quelle: Wikimedia Commons. Eine andere Möglichkeit, Anilin zu erhalten.
C6H5-NEIN2 + 3 co + h2O → c6H5-NH2 + 3 co2
Bei der Erlangung anderer chemischer Verbindungen
Nitobenzol ist der Ausgangspunkt, um eine Vielzahl von verwendeten Verbindungen wie Farbstoffen, Pestizide, Medikamente und Kosmetika zu erhalten.
 Einige Farbstoffe werden dank Nitrobenzol erhalten. Autor: Edith Lüthi. Quelle: Pixabay.
Einige Farbstoffe werden dank Nitrobenzol erhalten. Autor: Edith Lüthi. Quelle: Pixabay. Zum Beispiel ermöglicht es, 1,3-Dinitrobencen zu erhalten, die durch Chlorierung (Zugabe von Chlor) und Reduktion (Eliminierung von Sauerstoffatomen) 3-Chloranylin erzeugt. Dies wird als Vermittler für Pestizide, Farbstoffe und Medikamente verwendet.
Nitobenzol wurde verwendet, um Benchidin vorzubereiten, der ein Farbstoff ist. Darüber hinaus dient Nitrobenzol unter anderem Quinolin, Azobenzol, Methanylsäure, Dyitobenzol, Isozianat oder Pyroxilin unter anderem.
In mehreren Anwendungen
Nitobenzol wird verwendet oder verwendet als:
Kann Ihnen dienen: ungesättigte Kohlenwasserstoffe- Extraktionslösungsmittel für die Reinigung von Schmierölen, die in Maschinen verwendet werden
- Lösungsmittel für Celluloseethers
- Mischungszutat für polnische Metalle
- In Seifen
- In Gemischen für polnische Schuhe
- Sprühfarbenkonservator
- Bodenpoliermischungskomponente
- Mandel -Essence -Ersatz
- In der Parfümindustrie
- In der Herstellung von synthetischen Gummi
- Lösungsmittel in verschiedenen Prozessen
 Nitobenzol ist Teil einiger Mischungen für polnische Schuhe. D-Kuru [CC BY-SA 3.0 at (https: // creativeCommons.Org/lizenzen/by-sa/3.0/at/Tat.In)]. Quelle: Wikimedia Commons.
Nitobenzol ist Teil einiger Mischungen für polnische Schuhe. D-Kuru [CC BY-SA 3.0 at (https: // creativeCommons.Org/lizenzen/by-sa/3.0/at/Tat.In)]. Quelle: Wikimedia Commons. Risiken
Nitobenzol ist durch Inhalation, Aufnahme und Absorption durch die Haut toxisch.
Reizen Sie die Haut, die Augen und die Atemwege. Es kann eine Art von Anämie verursachen, die als Methämoglobinämie bezeichnet wird und die dazu besteht.
Darüber hinaus verursacht Nitrobencene Dyspnoe, Schwindel, verärgerte Sicht, Atemmangel, Zusammenbruch und Tod. Es schädigt auch die Leber-, Milz-, Nieren- und Zentralnervensystem.
Es wird geschätzt, dass es sich um ein Mutagen handeln kann und möglicherweise menschlichen Krebs verursacht, da es ihn bei Tieren verursacht hat.
Zusätzlich sollte Nitrobencene in der Umwelt nicht verworfen werden. Die Toxizität gegenüber Tieren, Pflanzen und Mikroorganismen macht es für Ökosysteme sehr schädlich.
Die Toxizität gegenüber Mikroorganismen verringert die biologische Abbaubarkeit.
Behandlungen für die Beseitigung der Umwelt
Die Umweltverschmutzung mit Nitrobencene kann durch die Verschwendung der verschiedenen Branchen auftreten, die sie nutzen, z. B. die Farbindustrie oder die der Sprengstoff.
Nitobenzol ist unter natürlichen Bedingungen sehr giftig und schwer zu unterbrechen. Aus diesem Grund kann es zu schweren Trinkverschmutzung und Bewässerungssystemen führen.
Aufgrund seiner hohen Stabilität und Toxizität gegenüber Mikroorganismen wird es häufig als Modell in Abwasserbehandlungsstudien ausgewählt.
Es werden verschiedene Möglichkeiten untersucht, um kontaminierte Wassernitrobenzol zu beseitigen. Einer von ihnen ist der photokatalytische Abbau, dh Sunlight als Beschleuniger der Abbaureaktion in Gegenwart von Titandioxid von Titanium2.
 Mit einem Sonnenlichtreaktor ist es möglich, die Wasserverschmutzung mit Nitrobencene zu beseitigen. Mihai-Cosmin Pascariu [CC BY-SA (https: // creevecommons.Org/lizenzen/by-sa/4.0)]]. Quelle: Wikimedia Commons.
Mit einem Sonnenlichtreaktor ist es möglich, die Wasserverschmutzung mit Nitrobencene zu beseitigen. Mihai-Cosmin Pascariu [CC BY-SA (https: // creevecommons.Org/lizenzen/by-sa/4.0)]]. Quelle: Wikimedia Commons. Mikroelektrolyseverfahren wurden ebenfalls erfolgreich mit einem Eisenkatalysator (Faith) und Kupfer (CU) in Keramik getestet. Die Mikroelektrolyse ermöglicht es Nitrobenzol, sich durch einen elektrischen Strom zu zersetzen.
Verweise
- ODER.S. Nationalbibliothek für Medizin. (2019). Nitrobenzol. Aus Pubchem geborgen.NCBI.NLM.NIH.Regierung.
- Morrison, r.T. und Boyd, r.N. (2002). Organische Chemie. 6. Ausgabe. Prentice-Hall.
- Moldoveanu, s.C. (2019). Pyrolyse anderer Stickstoffzählungsverbindungen. In der Pyrolyse organischer Moleküle (zweite Ausgabe). Von Scientedirect erholt.com.
- Smith, p.W.G. et al. (1969). Aromatische Nitration-Nitro-Verbindungen. Elektrophile Substitutionen. In der aromatischen Chemie. Von Scientedirect erholt.com.
- Windholz, m. et al. (Herausgeber) (1983). Der Merck Index. Eine Enyclopedia aus Chemikalien, Medikamenten und biologischen. Zehnte Ausgabe. Merck & co., Inc.
- Ullmanns Enzyklopädie der industriellen Chemie. (1990). FÜNFTE AUSGABE. Band A22. VCH Verlagsgellschaft MBH.
- Whang, t.-J. et al. (2012). UV-gegründete photokatalytische Abbau von Nitrobenzol durch Titania-Bindung auf Quarzrohr. Internationales Journal of PhotoEergy, Band 2012, Artikel ID 681941. Hyndawi erholte sich.com.
- Shikata, t. et al. (2014). Nitrobenzol Anti-Parallel-Dimer-Bildung in nicht-polaren Lösungsmitteln. AIP Advances 4, 067130 (2014). Von doaj geborgen.Org.
- Krogul-Obczak, a. et al. (2019). Reduktion von Nitrobenzol auf Anilin durch CO/H2Oder im Zeugen von Palladium -Nanopartikeln. Catalysts 2019, 9, 404. MDPI erholt sich.com.
- Yang, b. et al. (2019). Produktion, Eigenschaften und Anwendung von Fe/Cu-katalytisch-ceramisch-fickler für Nitrobenzolverbindungen Abwasserbehandlung. Catalysts 2019, 9, 11. MDPI erholt sich.com.
- « Mechanische Vorteilsformel, Gleichungen, Berechnung und Beispiele
- 110 Ewige Liebesphrasen für Freunde und Ehemänner »

