Koordinationsnummer Was ist, Berechnung, Beispiele

- 2234
- 505
- Said Ganzmann
Er Koordinationsnummer Es ist die Menge an Atomen, Ionen oder Molekülen, die mit einem Zentrum in Ionen- und Koordinationsverbindungen interagieren. Dieses Konzept kann auch auf die Moleküle angewendet werden, wobei berücksichtigt werden, wie viele Atome miteinander verbunden sind, anstatt mit der Anzahl ihrer Links.
Diese Zahl ist wichtig, da sie die Geometrien der Komplexe, die Dichten ihrer materiellen Phasen und sogar den stereochemischen (räumlichen) Charakter ihrer Reaktivitäten definiert. Um ihre Definition zu vereinfachen, gelten sie als Nachbar, das ein bestimmtes Zentrum umgibt.
 In einem Gebiet mit Münzen können wir zu schätzen wissen, was unter der Koordinationsnummer gemeint ist
In einem Gebiet mit Münzen können wir zu schätzen wissen, was unter der Koordinationsnummer gemeint ist Betrachten Sie zum Beispiel den Boden, der aus oberen Bildmünzen besteht. Alle Münzen haben die gleiche Größe, und wenn jeder beobachtet wird, ist sie von sechs anderen umgeben; Das heißt, sie haben sechs Nachbarn und damit die Koordinationsnummer (c.N.) Für die Münzen ist es 6. Die gleiche Idee erstreckt sich jetzt auf dreidimensionale Raum.
Wenn ihre Radios ungleich sind, haben nicht alle die gleiche Koordinationsnummer. Zum Beispiel: Je größer die Währung ist, desto mehr Nachbarn kann es mit einer größeren Anzahl von Münzen um ihn herum interagieren. Das Gegenteil geschieht mit kleinen Münzen.
[TOC]
Koordinationsnummer -Konzept
Vs Ion Funkeln. Koordinationsnummer
Die Koordinationsnummer ist die Anzahl der nächsten Nachbarn und die im Prinzip direkt mit einem Zentrum interagieren, was hauptsächlich ein Metallion ist. Also legen wir die Münzen beiseite, um stattdessen Kugeln zu berücksichtigen.
Dieses metallische Ion mN+, Wo N Es entspricht seiner Oxidation oder Valencia -Zahl, wechselwirkt mit anderen Nachbarn (ionisch oder molekular), die Liganden genannt werden. Je höher es N (+2, +3 usw.), kleiner wird m seinN+ Und folglich werden die Liganden gezwungen sein, sich mehr zu nähern, um mit M zu interagierenN+.
Kann Ihnen dienen: Butchrisches Fett: Erhalten, Typen, Zusammensetzung, Verwendungsmöglichkeiten, VorteileDas folgende Bild zeigt das obige:
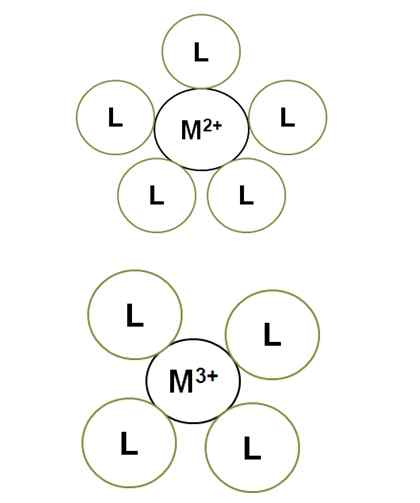 Variation der Koordinationszahl mit der zentralen Ionenbelastung. Quelle: Gabriel Bolívar.
Variation der Koordinationszahl mit der zentralen Ionenbelastung. Quelle: Gabriel Bolívar. M2+ Im erleuchteten Komplex hat es eine Koordinationszahl von 5: Es ist von 5 Liganden umgeben l. Inzwischen m3+ hat eine 4 Koordinationsnummer. Das liegt daran, dass m3+, Für eine größere Lastgröße, seine Radiusverträge und daher müssen sich die Bindemittel mehr nähern, was ihre elektronischen Abstoßungen erhöht.
Deshalb von sperrigen zentralen Ionen, wie z. B. diejenigen, die zu Blockmetallen gehören F, oder zur zweiten oder dritten Periode des Blocks D, Sie haben tendenziell höhere Koordinationszahlen (c.N. > 6).
Dichten
Nehmen wir jetzt an, dass der M -Komplex nun3+ unterzogen sich dem Druck. Ein Punkt kommt an, an dem der Druck so ist, dass eine andere Verbindung wahrscheinlich koordiniert ist oder mit M interagiert3+. Das heißt, seine Koordinationszahl wird von 4 auf 5 steigen.
Im Allgemeinen erhöhen Druck die Koordinationszahlen, da sich die Nachbarn gegenseitig auf das zentrale Ion oder Atom zwingen. Folglich werden die materiellen Phasen dieser Substanzen dichter, kompakter.
Geometrien
Höhere Illustrationen sagen nichts über Geometrien um m aus2+ oder m3+. Wir wissen jedoch, dass ein Quadrat vier Eckpunkte oder Ecken hat, genau wie ein Tetraeder.
Diese Argumentation wird zu dem Schluss gezogen, dass Geometrie um m3+, deren c.N. Es ist 4, es muss tetraedrisch oder quadratisch sein. Aber welcher der beiden? Inzwischen Geometrien für m2+, deren c.N. Es ist 5, sie können eine quadratische Pyramide oder eine trigonale bipiramidale sein.
Jeweils c.N. Es hat mehrere mögliche Geometrien in Verbindung gebracht, die die Bindemittel in einem günstigen Abstand positionieren, so dass es die geringste Abstoßung zwischen ihnen gibt.
Kann Ihnen dienen: Interatomische LinksWie wird die Koordinationsnummer berechnet oder bestimmt?
Die Koordinationsnummer kann manchmal direkt aus der fraglichen zusammengesetzten Formel berechnet werden. Angenommen, der anionische Komplex [NI (CN)5]3-. Was ist die Koordinationsnummer für das Nickel -Ion oder2+? Es reicht aus, den stöchiometrischen Koeffizienten 5 zu beobachten, was darauf hinweist, dass es 5 cn Anionen gibt- koordiniert oder interagiert mit dem Zentrum von Ni2+.
Es ist jedoch nicht immer einfach. Zum Beispiel scheint die CUCN -Verbindung eine Koordinationszahl von 1 für Cu zu haben2+ Wie für den CN-. Es besteht jedoch aus tatsächlich Cu-CN-CU-CN-Polymerketten, sodass die korrekte Koordinationsnummer 2 ist.
Deshalb ist die Koordinationsnummer vorzuziehen, sie zu bestimmen, anstatt sie zu berechnen. Als? Bestimmung der ionischen oder molekularen Strukturen der Verbindungen. Dies ist dank instrumentaler Techniken wie X -Strahlenbeugung, Neutronen oder Elektronen möglich.
Beispiele für Koordinationsnummern
Als nächstes und schließlich werden einige Beispiele für Verbindungen für jede der häufigsten Koordinationszahlen erwähnt. Ebenso wird es gesagt, was ihre jeweiligen Geometrien sind.
C.N. 2
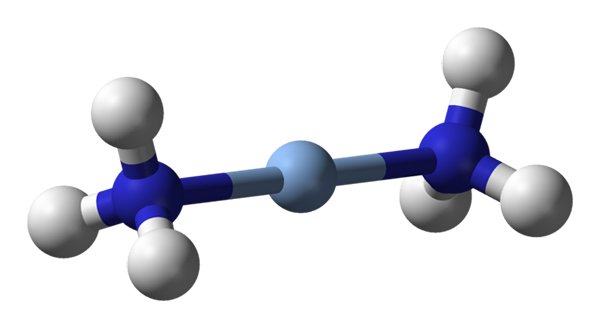 Hier wird die lineare Geometrie von [Ag (NH3) 2] beobachtet+. Quelle: Benjah-BMM27 / Public Domain
Hier wird die lineare Geometrie von [Ag (NH3) 2] beobachtet+. Quelle: Benjah-BMM27 / Public Domain A c.N. gleich 2 bedeutet, dass das zentrale Atom oder Ion nur zwei Nachbarn hat. Daher sprechen wir über Verbindungen, die verpflichtet über lineare Geometrien sind. Zwischen ihnen haben wir:
-Hg (Ch3)2
-[AG (NH3)2]+
-PH3Paucl
C.N. 3
 Jedes Kohlenstoffatom in diesem Graphitblatt ist mit drei anderen verbunden, sodass es drei Nachbarn hat. Quelle: Benjah-BMM27 / Public Domain
Jedes Kohlenstoffatom in diesem Graphitblatt ist mit drei anderen verbunden, sodass es drei Nachbarn hat. Quelle: Benjah-BMM27 / Public Domain A c.N. gleich 3 bedeutet, dass das zentrale Atom oder Ion von drei Nachbarn umgeben ist. Wir haben dann Geometrien wie: trigonale (dreieckige) Ebene, trigonale Pyramide und T -Form. Beispiele für Verbindungen mit dieser Koordinationsnummer sind:
Es kann Ihnen dienen: Atommasse: Definition, Typen, wie man sie berechnet, Beispiele-[Cu (CN)3]2-
-[PT (PCY3)3], Wo sich PCY auf den Tricylohexylophospin -Liganden bezieht
-Graphit
C.N. 4
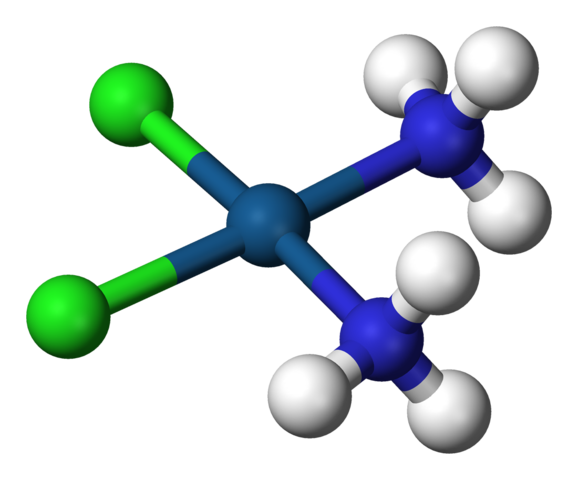 Quadratgeometrie von Cisplatin, CIS-PTCL2 (NH3) 2. Quelle: Benjah-BMM27 / Public Domain
Quadratgeometrie von Cisplatin, CIS-PTCL2 (NH3) 2. Quelle: Benjah-BMM27 / Public Domain A c.N. gleich 4 bedeutet, dass das zentrale Atom oder Ion von vier Nachbarn umgeben ist. Die möglichen Geometrien sind tetraedrisch oder quadratisch. Beispiele für Verbindungen mit dieser Koordinationsnummer haben die folgenden:
-CH4
-Cocl2Pyr2
-Cis-ptcl2(NH3)2
-[Alcl4]-
-[Muhen4]2-
-SNCL4
-[Cro4]2-
-[Mno4]2-
All diese Beispiele mit Ausnahme des CIS-PTCL2(NH3)2, Sie sind tetraedrische Geometrien.
C.N. 5
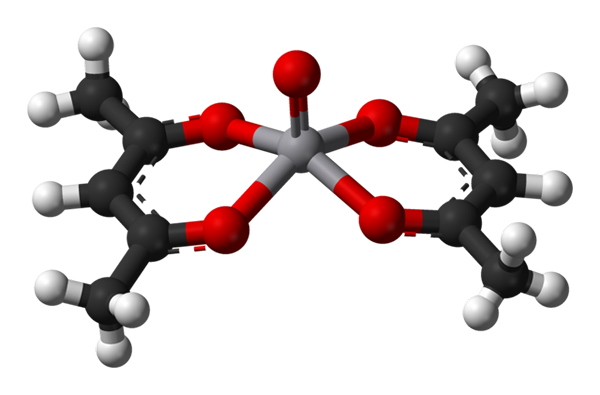 Quadratpyramidengeometrie für VO (ACAC) 2. Quelle: Benjah-BMM27 / Public Domain.
Quadratpyramidengeometrie für VO (ACAC) 2. Quelle: Benjah-BMM27 / Public Domain. A c.N. Gleich 5 bedeutet, dass das Atom oder das zentrale Ion mit fünf Nachbarn koordiniert oder interagiert wird. Die bereits erwähnten Geometrien sind die quadratische Pyramide oder trigonale Bipiramiden. Als Beispiele haben wir Folgendes:
-[COBRN (CH2CH2Nme2)3]
-[Fe (CO)5]
-VO (ACAC)2, ACAC ist der Acetylacetonat -Ligand
C.N. 6
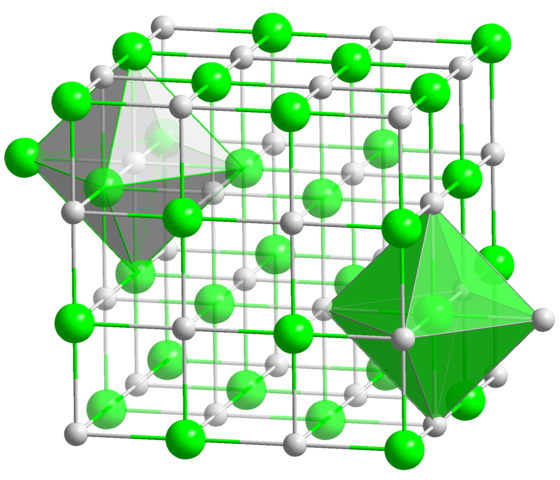 In der kristallinen Struktur des NaCl haben jede Na+ -Ion und Cl-Sechs Nachbarn, so dass dies die Koordinationszahl für beide Ionen ist (siehe Octaeder). Quelle: Solid State / Public Domain
In der kristallinen Struktur des NaCl haben jede Na+ -Ion und Cl-Sechs Nachbarn, so dass dies die Koordinationszahl für beide Ionen ist (siehe Octaeder). Quelle: Solid State / Public Domain Dies ist bei weitem die häufigste Koordinationszahl unter allen Verbindungen. Denken Sie an das Beispiel der Prinzipmünzen. Aber anstelle ihrer Lieblingsgeometrie ist die eines flachen Sechsecks, der dem des Oktaeders (normal oder verzerrt) zusätzlich zum trigonalen Prisma entspricht. Einige von vielen Beispielen für Verbindungen mit dieser Koordinationsnummer sind:
-[Alf6]3-
-[CO (NH3)6]3+
-[Zr (wählen3)6]2-
-NaCl (ja, Tischsalz)
-Mos2, Beachten Sie, dass c.N. Für diese Verbindung ist nicht 2
Andere
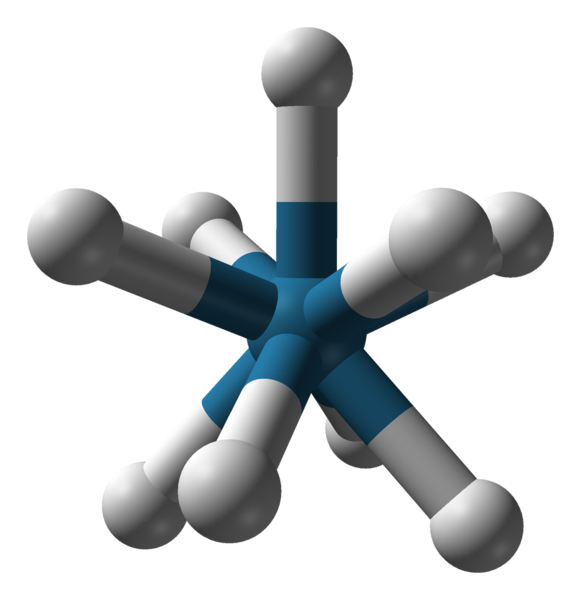 Triapadische Prisma -Geometrie des Anion [REH9] 2-. Quelle: Benjah-BMM27 / Public Domain.
Triapadische Prisma -Geometrie des Anion [REH9] 2-. Quelle: Benjah-BMM27 / Public Domain. Es gibt andere Koordinationsnummern von 7 bis 15. So dass c.N. Seien Sie hoch, das zentrale Ion oder das Atom muss sehr groß sein, wenig Ladung und gleichzeitig müssen die Liganden sehr klein sein. Einige Beispiele für Verbindungen mit solchen c.N. Sie sind unten und zu Ende:
-K3[NBOF6], C.N. 7 und OctAedro Geometrie
-[MO (CN)8]3-
-[Zr (OX)4]2-, Ochsen Oxalatligand sein
-[Reh9]2-
-[Stirnrunzeln3)6]2-, C.N. gleich 12
Verweise
- Whitten, Davis, Peck & Stanley. (2008). Chemie. (8. Aufl.). Cengage Lernen.
- Shiver & Atkins. (2008). Anorganische Chemie. (Vierte Edition). Mc Graw Hill.
- Wikipedia. (2020). Koordinationsnummer. Abgerufen von: in.Wikipedia.Org
- Die Herausgeber von Enyclopaedia Britannica. (S.F.). Koordinationsnummer. Erholt von: Britannica.com
- Prof. Robert J. Lancashire. (15. August 2020). Koordinationsnummern und Geometrie. Chemistry Librettexts. Erholt von: Chem.Librettexts.Org
- Helmestine, Anne Marie, ph.D. (28. August 2020). Koordinationsnummer -Definition in der Chemie. Erholt von: thoughtco.com

