Quantenzahlen für die Verwendung und was sind
- 805
- 73
- Jasmine Kupprion
Der NQuantenumeters Sie werden verwendet, um den Quantenzustand der Elektronen im Atom zu beschreiben und in der Lösung der Schrödinger -Gleichung zum einfachsten von allen zu stammen: der Wasserstoff.
Schrödingers Gleichung ist eine Differentialgleichung, deren Lösungen sind Wellenfunktionen und sie werden durch den griechischen Buchstaben ψ bezeichnet. Unendliche Lösungen können angehoben werden, und sein Quadrat entspricht der Wahrscheinlichkeit, das Elektron in einem kleinen Raumbereich zu finden, genannt Orbital.
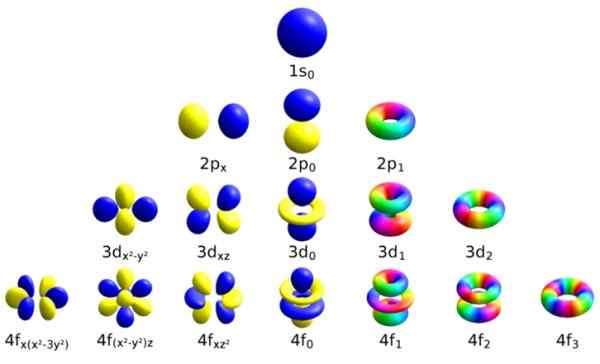
 Jedes dieser Atomorbitale wird durch eine bestimmte Menge von Quantenzahlen unterschieden. Quelle: Wikimedia Commons.
Jedes dieser Atomorbitale wird durch eine bestimmte Menge von Quantenzahlen unterschieden. Quelle: Wikimedia Commons. Jedes Orbital hat Merkmale definiert, die es von anderen unterscheiden, wie Energie, Winkelimpuls und Spin, eine völlig Quanteneigenschaft des Elektrons und das ist unter anderem für magnetische Effekte verantwortlich.
Der Weg zur Identifizierung jedes Orbitals besteht darin, es durch eine Reihe von Zahlen zu unterscheiden, die es beschreiben, und diese sind genau die Quantenzahlen:
-N: Ist die Hauptquantenzahl.
-ℓ: die azimutale Quantenzahl.
-Mℓ, Es ist die Magnetzahl.
-MS, Die Spin -Nummer.
[TOC]
Was sind Quantenzahlen für?
Quantenzahlen dienen dazu, den Elektronenzustand im Atom zu beschreiben. Das Atommodell, bei dem sich das Elektron um den Kern dreht.
Deshalb machte dänische Niels Bohr (1885-1962) 1913 einen mutigen Vorschlag: Das Elektron kann nur in bestimmten stabilen Umlaufbahnen gefunden werden, deren Größe von einer ganzzahligen Zahl namens N abhängt.
Später, im Jahr 1925. Sind die Wellenfunktionen ψ am Anfang erwähnt.
Diese Differentialgleichung umfasst die drei räumlichen Koordinaten sowie die Zeit, aber wenn sie nicht enthalten ist, ist die Lösung der Schrödinger -Gleichung analog zu der einer stationären Welle (eine Welle, die sich zwischen bestimmten Grenzen ausbreitet).
Wellenfunktionen
Die unabhängige Zeitgleichung von Schrödinger ist in sphärischen Koordinaten aufgelöst und die Lösung als Produkt von drei Funktionen geschrieben, eine für jede räumliche Variable. In diesem Koordinatensystem, anstatt die Koordinaten der kartesischen Achsen zu verwenden X, Und Und z Koordinaten werden verwendet R, θ Und φ. Hier entlang:
Kann Ihnen dienen: Parallele Schaltungψ (r, θ, φ) = r (r) ≤f (θ) · g (φ)
Die Wellenfunktion ist trotz der Quantenmechanik immateriell, dass die Quadratamplitude:
| ψ (r, θ, φ) |2
Das heißt, das Modul oder der absolute Wert der Quadratfunktion der Wellenfunktion ist eine reelle Zahl, die die Wahrscheinlichkeit darstellt, das Elektron in einem bestimmten Bereich um den Punkt zu finden, dessen Koordinaten sind R, θ Und φ.
Und diese Tatsache ist etwas konkreteres und greifbareres.
Um die Wellenfunktion zu finden, müssen Sie drei gewöhnliche Differentialgleichungen lösen, eine für jede Variable R, θ Und φ.
Die Lösungen jeder Gleichung, die die Funktionen r (r), f (θ) und g (φ) sind, enthalten die ersten drei genannten Quantenzahlen.
Was sind die Quantenzahlen??
Im Folgenden beschreiben wir kurz die Art jeder Quantenzahl. Die ersten drei entstehen, wie oben erwähnt, aus den Lösungen der Schrödinger -Gleichung.
Die vierte Zahl wurde 1928 von Paul Dirac (1902 - 1984) hinzugefügt.
Hauptquantenzahl
Es wird mit bezeichnet durch N und zeigt die Größe des zulässigen Orbitals sowie die Energie des Elektrons an. Je höher sein Wert ist, desto mehr wird das Elektron des Kerns und seine Energie auch sein, aber im Gegenzug reduziert es seine Stabilität.
Diese Zahl ergibt sich aus der R (R) -Funktion, die die Wahrscheinlichkeit ist, das Elektron in einem bestimmten Abstand zu finden R des Kerns, der bestimmt wird durch:

-Planckkonstante: H = 6,626 × 10 -3. 4 J.S
-Elektronenmasse mUnd = 9.1 × 10-31 kg
-Elektronslast: e = 1.6 × 10-19 C.
-Elektrostatische Konstante: k = 9 × 10 9 N.M2/C2
Wenn n = 1 dem Bohr -Radius entspricht, ist der Wert von ungefähr 5 wert.3 × 10–11 M.
Mit Ausnahme der ersten Schicht werden die anderen in Subkaps oder Sub -Levels unterteilt. Jede Schicht hat eine Energie im Volt -Elektron, die von:
Kann Ihnen dienen: Mechanische Wellen: Eigenschaften, Eigenschaften, Formeln, Typen
- K (n = 1)
- L (n = 2)
- M (n = 3)
- N (n = 4)
- Oder (n = 5)
- P (n = 6)
- Q (n = 7).
Theoretisch gibt es keine Obergrenze für n, aber in der Praxis wird beobachtet, dass es nur n = 8 erreicht. Die am wenigsten mögliche Energie entspricht n = 1 und ist die der Grundzustand.
Azimutale Quantenzahl oder Winkelimpuls
Mit dem kursiven Buchstaben bestimmt diese Zahl die Form der Orbitale, wenn die Größe des orbitalen Winkelimpulses des Elektrons quantifiziert wird.
Sie können beispielsweise die gesamten und positiven Werte zwischen 0 und N-1 einnehmen:
-Wenn n = 1, dann ℓ = 0 und es gibt einen einzelnen Sub -Level.
-Wenn n = 2, kann ℓ 0 oder 1 wert sein, sodass Sie zwei Sub -Levels haben.
-Und wenn n = 3, dann nimmt ℓ die Werte 0, 1 und 2 an und es gibt 3 Sub -Levels.
Es kann auf unbestimmte Zeit verfolgt werden, obwohl in der Praxis n bis zu 8 erreicht wird. Sub -Levels werden durch Buchstaben bezeichnet: S, P, D, F Und G Und sie nutzen die Energie.
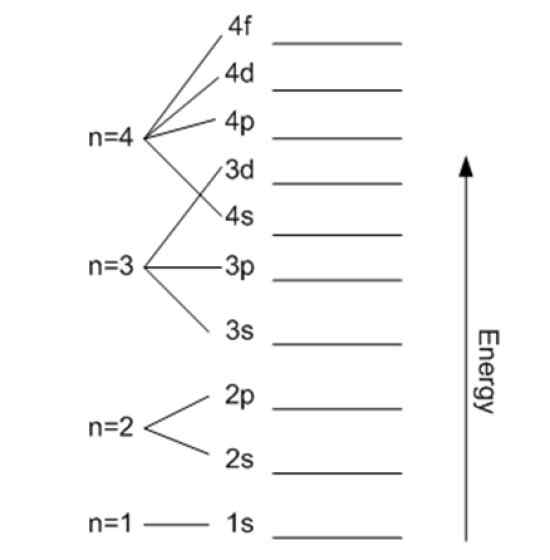 Energie hängt mit der Hauptquantenzahl zusammen. Quelle: Wikimedia Commons.
Energie hängt mit der Hauptquantenzahl zusammen. Quelle: Wikimedia Commons. Magnetische Quantenzahl mℓ
Diese Zahl entscheidet über die Ausrichtung des Orbitals im Raum und ihr Wert hängt von der ℓ ab.
Für eine gegebene ℓ gibt es (2ℓ+1) ganze Werte von m ℓ, entsprechend den jeweiligen Orbitalen. Diese sind:
-ℓ, ( - ℓ+1),… 0,… (+ℓ -1),+ℓ.
Beispiel
Wenn n = 2, wissen wir, dass ℓ = 0 und ℓ = 1, dann m ℓ Nehmen Sie die folgenden Werte:
-Für ℓ = 0: m ℓ = 0.
-Für ℓ = 1: m ℓ = -1, m ℓ = 0, m ℓ = +1
Das Orbital n = 2 hat zwei Sub -Levels, die erste mit n = 2, ℓ = 0 und m ℓ = 0. Dann haben wir den zweiten Sub -Level: n = 2, ℓ = 1 mit 3 Orbitalen:
- N = 2, ℓ = 1, m ℓ = -1
- N = 2, ℓ = 1, m ℓ = 0
- N = 2, ℓ = 1, m ℓ = +1
Die drei Orbitale haben die gleiche Energie, aber die gleiche räumliche Ausrichtung.
Quantenzahl von Spin mS
Bei der Lösung der Schrödinger -Gleichung in drei Dimensionen entstehen die bereits beschriebenen Zahlen. In Wasserstoff wird jedoch eine noch weitere Struktur beobachtet, als diese Zahlen nicht ausreichen, um zu erklären.
Es kann Ihnen dienen: Gase Konstante: Was ist, Berechnung und BeispieleDaher schlug 1921 ein weiterer Körperbau, Wolfgang Pauli, die Existenz einer vierten Zahl vor: die Spin -Nummer mS, Das erfordert Werte von +½ oder -½.
Mit dieser Zahl wird eine sehr wichtige Eigenschaft des Elektrons beschrieben, nämlich die drehen, Wort, das aus Englisch kommt drehen (Umdrehung dich selbst). Und der Dreh wiederum hängt mit den magnetischen Eigenschaften des Atoms zusammen.
Eine Möglichkeit, den Spin zu verstehen, besteht darin, sich vorzustellen, dass sich das Elektron dank einer Rotation um seine eigene Achse wie ein winziger magnetischer Dipol (ein Magnet mit Nord- und Südpolen) verhält. Die Kurve kann in der gleichen Richtung wie die Taktnadeln oder in die entgegengesetzte Richtung sein.
Obwohl Pauli die Existenz dieser Zahl vorschlug, hatten die Ergebnisse eines Experiments von Otto Stern und Walter Gerlach im Jahr 1922 bereits erwartet.
Diese Wissenschaftler gelang es, einen Strahl von Silberatomen durch die Anwendung eines ungleichmäßigen Magnetfelds zu teilen.
Der Wert von mS Es hängt nicht von n, ℓ und m ab ℓ. Grafisch wird es durch einen Pfeil dargestellt: Ein Aufwärtspfeil zeigt den Zeitplan und einen im Antihoran an.
Pauli -Ausschlussprinzip
Das Verhalten von Elektronen im Atom wird im Prinzip des Ausschlusses von Pauli zusammengefasst, was besagt, dass zwei Elektronen eines Atoms im selben Quantenzustand nicht existieren können.
Daher muss jedes Elektron einen anderen Satz von Quantenzahlen n, ℓ, m haben ℓ und MS.
Die Bedeutung der Quantenzahlen und dieses Prinzip liegt im Verständnis der Eigenschaften der Elemente in der Periodenzüchttabelle: Die Elektronen sind nach n und dann in Unterkaps nach ℓ und dem Rest der Zahlen in Schichten organisiert.
Verweise
- Alonso, m. 1971. Quanten- und statistische Grundlagen. Inter -American Educational Fund.
- Bauer, w. 2011. Physik für Ingenieurwesen und Wissenschaften. Band 1. Mc Graw Hill.
- Chang, R. 2013. Chemie. 11va. Auflage. MC Graw Hill Education.
- Eisberg-Resnick. 1989. Quantenphysik. Limusa - Wiley.
- Giambattista, a. 2010. Physik. 2. Ed. McGraw Hill.
- Rex, a. 2011. Grundlagen der Physik. Pearson.
- Tippens, p. 2011. Physik: Konzepte und Anwendungen. 7. Ausgabe. McGraw Hill.
- « Vorwürfe geschriebener Inhalt, wie es geht, Modell
- Typenumgebungen Typen und ihre Eigenschaften, Beispiele »

