Keine Metallgeschichte, Eigenschaften, Gruppen, verwendet

- 4790
- 954
- René Riediger
Der Keine Metalle Sie sind eine Gruppe von Elementen, die sich auf der rechten Seite des Periodensystems befinden, mit Ausnahme von Wasserstoff, die sich in Gruppe 1 (AI) befindet, zusammen mit alkalischen Metallen. Wenn Sie wissen möchten, was sie sind, müssen Sie in die obere rechte Ecke des P -Blocks schauen.
Nicht -Metallatome sind relativ klein und ihre externe elektronische Schicht hat eine erhöhte Anzahl von Elektronen. Unter den nicht -metallischen Elementen können Feststoffe, Flüssigkeiten und Gase gefunden werden; Obwohl sie sich größtenteils in einem gasförmigen Zustand befinden, bereichern einige von ihnen die Atmosphäre.
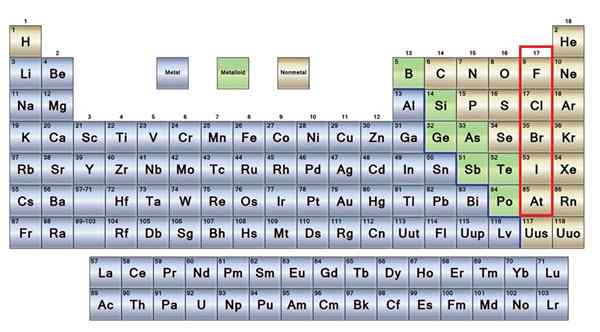 Nicht -metallische Elemente in Braun
Nicht -metallische Elemente in Braun Ein großer Teil der Nicht -Metalle ist in allen Lebewesen in Form von Verbindungen und Makromolekülen vorhanden. Zum Beispiel: Kohlenstoff, Sauerstoff und Wasserstoff sind in allen Proteinen, Lipiden, Kohlenhydraten und Nukleinsäuren vorhanden.
Phosphor ist in allen Nukleinsäuren und in einigen Kohlenhydraten und Lipiden vorhanden. Schwefel kommt in vielen Proteinen vor. Stickstoff ist Teil aller Nukleinsäuren und Proteine.
Andererseits bestehen unterirdische, Methangase und Ölrohs fast aus nicht -metallischen Elementen. In der Tat geben Kohlenwasserstoffe (Kohlenstoff und Wasserstoff) eine Vorstellung davon.
[TOC]
Geschichte
Von der Antike (3750 bis.C.) Die Ägypter nutzten Kohle, um das in ihren Mineralien vorhandene Kupfer wie die Corvelita und den Malachit zu reduzieren.
1669 gelang es Hennin Brand, gesammelte Urinphosphor zu isolieren. Henry Cavendish (1776) erreichte die Identifizierung von Wasserstoff, obwohl mehrere Forscher, darunter Robert Boyle (1670), Wasserstoff produzierte, indem er eine starke Säure mit einem Metall reagierte.
Carl Scheele erzeugte Sauerstoff durch Erhitzen von Quecksilberoxid mit Nitraten (1771). Cottois gelang es, das Jod zu isolieren, während er versuchte, Salpeter aus Seetang vorzubereiten (1811). Balard und Gmelin isolierten den Bome (1825).
Im Jahr 1868 unabhängig Janssen und Locker unabhängig. Moissan gelang es, Fluorid zu isolieren (1886).
1894 entdeckten Lord Rayleigh und Ramsey Argon, indem sie Stickstoffeigenschaften studierten. Ramsay und Travers (1898) isolierten das Crypton, Neon und Xenon des flüssigen Argons durch kryogene Destillation der Luft.
Physikalische und chemische Eigenschaften
 Schwefel ist eines der repräsentativsten nicht -metallischen Elemente. Quelle: Ben Mills über Wikipedia.
Schwefel ist eines der repräsentativsten nicht -metallischen Elemente. Quelle: Ben Mills über Wikipedia. Physisch
Einige der physikalischen Eigenschaften von Nicht -Metals sind:
-Sie haben eine geringe elektrische Leitfähigkeit, mit Ausnahme von Kohlenstoff in Form von Graphit, was ein guter Stromleiter ist.
Kann Ihnen dienen: Heptano (C7H16): Struktur, Eigenschaften und Verwendung-Sie können unter dem physischen Erscheinungsbild von Festkörpern, Flüssigkeiten oder Gasen auftreten.
-Sie haben eine geringe thermische Leitfähigkeit, mit Ausnahme von Kohlenstoff in Form von Diamanten, die sich nicht wie ein thermischer Isolator verhalten.
-Im Gegensatz zu Metallhelligkeit Metall haben sie wenig Glanz.
-Nicht metallische Feststoffe sind spröde, daher sind sie nicht duktil oder formbar.
-Sie haben niedrige Schmelz- und Siedepunkte.
-Sie können verschiedene kristalline Strukturen aufweisen. Somit haben Phosphor, Sauerstoff und Fluorid eine kubische kristalline Struktur; Wasserstoff, Kohlenstoff und Stickstoff, sechseckell; und Schwefel, Chlor, Brom und Jod, ortorrombisch.
Chemie
Nicht -Metalle sind durch hohe Ionisationsenergie und einen hohen Elektronegativitätswert gekennzeichnet. Fluor hat zum Beispiel die größte Elektronegativität (3,98), die das reaktivste Element von Nicht -Metals ist.
Überraschenderweise haben edle Gase Helium (5,5) und Neon (4,84) die größte Elektronegativität. Sie sind jedoch chemisch inert, weil sie externe elektronische Schichten voll haben.
Nicht -Metalle bilden ionische Verbindungen mit Metallen und kovalent mit Nicht -Metalen.
Nicht -metallische Elemente bilden Diatommoleküle, die durch kovalente Bindungen verbunden sind. Inzwischen sind die Atome von edlen Gasen in Form von Atomeinheiten.
Sie bilden Säuroxide, die mit Wasser ursprünglich Säuren reagieren.
Nicht -Metall- und Elementegruppen

Gruppe 1
Es besteht aus Wasserstoff, einem farblosen und Toilettengas, Dialotomie. Oxidationszustand +1. Es hat weniger Dichte als Luft. Im festen Zustand präsentiert es eine hexagonale kristalline Struktur. Wasserstoff ist ein wenig reaktives Element.
Gruppe 14
Kohlenstoff ist der einzige nicht metal, der zu dieser Gruppe gehört. Kohlenstoff in Form von Graphit ist ein glänzender Feststoff mit einer hexagonalen kristallinen Struktur. Hat eine hohe elektrische Leitfähigkeit. Die häufigsten Oxidationszustände sind +2 und +4.
Gruppe 15
Stickstoff
Farbloses und Toilettengas. Es ist ein kleines reaktives Element und leicht dichter als die Luft. Häufiger Oxidationszustände: -3 und +5. Diatommoleküle bilden, n2.
Passen
Fest, seine Farbe kann weiß, gelb oder schwarz sein. Wenig reaktiv. Ortorrombische kristalline Struktur. Elektronegativität 2,1. Häufiger Oxidationszustände: -3 und +5.
Gruppe 16
Sauerstoff
Farbloses Gas oder hellblau, Toilette. Im Allgemeinen nicht reaktiv. Kubikkristalline Struktur. Es ist ein Isolator und ein starkes Oxidationsmittel. Elektronegativität 3.5. Oxidationszustand -2
Schwefel
Leuchtend gelber fester, spröde, mäßig reaktiv. Ortorrombische kristalline Struktur. Kovalente Bindungen bilden. Elektronegativität 2.5. Häufiger Oxidationszustände: -2, +2, +4 und +6.
Selen
Schwarz grau oder rotes Feststoff. Graues Selen zeigt eine leichte anerkannte elektrische Leitfähigkeit. Es ist ein weicher und spröde Feststoff. Elektronegativität 2.4. Oxidationszustände: -2, +2, +4 und +6.
Kann Ihnen dienen: Kaliumhydroxid: Struktur, Eigenschaften, verwendetGruppe 17
Fluor
Es ist ein hellgelbes Gas, sehr giftig. Es ist ein sehr reaktives Element. Es wird als zweige2. In fester Zustand kristallisiert kubisch. Elektronegativität 3.98. Oxidationszustände -1.
Chlor
Es ist ein grün-gelbes Gas. Präsentiert Diatommoleküle, CL2. Es ist sehr reaktiv. Im Festzustand ist die kristalline Struktur ortorrombisch. Elektronegativität 3.0. Oxidationszustände: - 1, +1, +3, +5, +7.
Brom
Es ist eine rot-Café-Flüssigkeit. Elektronegativität 2.8. Oxidationszustände -1, +1, +3, +5 und +7.
Jod
Es ist ein schwarzer Feststoff, der beim Sublimaten einen violetten Dampf emittiert. Ortorrombische kristalline Struktur. Metalljodide sind ionisch. Elektronegativität 2.5. Oxidationszustände: -1, +1, +3, +5, y +7.
Astato
Es ist ein schwarzer Feststoff. Kubikkristalline Struktur im Gesicht zentriert. Elektronegativität 2,2. Es ist ein schwaches Oxidationsmittel.
Gruppe 18
Helium
Hat eine hohe thermische Leitfähigkeit. Elektronegativität 5.5. Es ist chemisch inert und nicht brennbar. Niedrige Dichte und hohe Fluidität.
Neon
Hohe Kühlkapazität im flüssigen Zustand. Elektronegativität 4.84. Es ist der am wenigsten reaktive Edelgase.
Argon
Es ist dichter als die Luft. Chemisch inert. Elektronegativität 3.2.
Krypton
Elektronegativität 2.94. Kann mit Fluorid reagieren, um Crypton -Differenz (KRF) zu bilden2).
Xenon
Kreuzt die Bluthirnbarriere. Reagiert auf elektrische Strom, das Licht erzeugt. Elektronegativität 2,2. Komplexe Form mit Fluor, Gold und Sauerstoff.
Radon
Es ist ein radioaktives Element. Elektronegativität 2.06. Formen Sie Verbindungen mit Fluorid (RNF2) und mit Sauerstoff (RNO3).
Anwendungen
Wasserstoff

Es wird im Raketenantrieb und als Kraftstoff in Automotoren verwendet, die Wasserstoff verwenden. Es wird in der Ammoniaksynthese (NH3) und in der Hydrierung von Fetten.
Kohlenstoff
Graphit wird zur Herstellung von Stiften und hohen Fasern verwendet, die bei der Ausarbeitung von Sportartikeln verwendet werden. Der Diamant wird als Juwel von großem Wert und in den Bohrbohrern als Schleifmittel verwendet. Kohlendioxid wird zur Ausarbeitung von Erfrischungsgetränken verwendet.
Stickstoff
Es wird bei der Herstellung von Ammoniak, Salpetersäure und Harnstoff verwendet. Stickstoff ist ein wesentliches Element für Pflanzen und wird in der Herstellung von Düngemitteln verwendet.
Passen
Weißer Phosphor wird als Ratikide, Insektizid und in der pyrotechnischen Industrie verwendet. Roter Phosphor wird in den Spielen hergestellt. Seine Verbindungen werden auch in der Düngemittelausarbeitung verwendet.
Sauerstoff
Sauerstoff wird zur Ausarbeitung von Stahl, Kunststoffen und Textilien verwendet. Es wird auch in Raketen, Sauerstofftherapie und Atemunterstützung in Flugzeugen, U -Booten und Weltraumflügen verwendet.
Kann Ihnen dienen: Erbio: Struktur, Eigenschaften, erhalten, verwendet, verwendetSchwefel
Es wird als Rohstoff für die Herstellung von Schwefelsäure, Schießpulver und bei der Vulkanisierung von Gummi verwendet. Sulfite werden verwendet, um Papier und Fungizid zu bleichern.
Selen
Es wird verwendet, um dem Glas eine scharlachrote rote Färbung zu vermitteln. Es wird auch verwendet, um die durch Glasverschmutzung mit Eisenverbindungen erzeugte grünliche Nuance zu neutralisieren. Es wird in photoelektrischen Zellen mit Anwendung an Türen und Aufzügen verwendet.
Fluor

Es wird Zahncremes hinzugefügt, um Karies zu verhindern. Wasserstofffluorid wird als Rohstoff für Teflon verwendet. Monoatomischer Fluor wird zur Herstellung von Halbleitern verwendet.
Chlor
Es wird für die Herstellung verschiedener Produkte wie PVC in extraktiver Metallurgie und Kohlenwasserstoffchlorierung verwendet. Chlor wird im Bleichmittel von Holz und Textilen verwendet. Es wird auch als Wasser Desinfektionsmittel verwendet.
Brom
Es wird bei der Herstellung von Silberbromid für lichtempfindliche Objektive und in fotografischen Filmen auch bei der Ausarbeitung des Beruhigungsmittelbromids und Dibromethan, einer Anti -Domain -Komponente von Benzin, verwendet.
Jod
Kaliumiodid (KI) wird hinzugefügt, um Schilddrüsen -Kropf zu verhindern. Jodtinktur wird als antiseptisch und keimt. Jod ist Teil von Schilddrüsenhormonen.
Helium
Es wird bei der Füllung von Heißluftballons verwendet und mit Sauerstoff für tiefes Wasseratmung gemischt. Es wird für Schweißnähte in einer inerten Atmosphäre verwendet und trägt dazu bei, sehr niedrige Forschungstemperaturen aufrechtzuerhalten.
Neon
In Glasrohre, die für die Wirkung von Elektrizität (Neonrote Lichter) aufleuchten,.
Argon
Es wird verwendet, um eine Atmosphäre zum Schweißen und zum Füllen von Glühlampen zu schaffen.
Xenon
Eine Mischung aus Xenon und Crypton wird bei der Herstellung von Blitzen mit großer Intensität in der kurzfristigen fotografischen Ausstellung verwendet.
Radon
Es wird bei der Behandlung von Krebstumoren durch Strahlentherapie verwendet.
Verweise
- Whitten, Davis, Peck & Stanley. (2008). Chemie. (8. Aufl.). Cengage Lernen.
- Shiver & Atkins. (2008). Anorganische Chemie. (Vierte Edition). Mc Graw Hill.
- Mathews, c. K., Van Holde, K. UND. Und ahern, k. G. (2002). Biochemie. Dritte Edition. Bearbeiten. Pearson-Addison Wesley
- Helmestine, Anne Marie, ph.D. (6. Oktober 2019). Was sind die Eigenschaften von Nichtmetallen? Erholt von: thoughtco.com
- Wikipedia. (2019). Nichtmetal. Abgerufen von: in.Wikipedia.Org
- Die Herausgeber von Enyclopaedia Britannica. (5. April 2016). Nichtmetal. Encyclopædia Britannica. Erholt von: Britannica.com
- Jose m. Gavira Vallejo. (27. Januar 2016). Was sind die Pnicogene? Und die Icosogenos, die Kristallogene, die Calcogene .. ? Abgerufen von: Triplenlace.com
- « Fluoror -Anamnese, Eigenschaften, Struktur, erhalten, Risiken, verwendet
- Was ist Typ und Eigenschaften »

