Spektrale Notation

- 2292
- 620
- Luca Holdt
 Tabelle, die die Ebenen und die Orbitale anzeigt
Tabelle, die die Ebenen und die Orbitale anzeigt Was ist spektrale Notation?
Der Spektrale Notation Es ist die Anordnung von Elektronen auf Energieniveaus um den Kern eines Atoms. Laut Bohrs altem Atommodell belegen Elektronen in den Umlaufbahnen um den Kern, von der ersten Schicht, die dem Kern, K, bis zur siebten Schicht Q, die am weitesten vom Kern entfernt ist.
In Bezug auf ein raffinierteres Quantenmechanikmodell werden K-Q-Schichten in eine Reihe von Orbitalen unterteilt, von denen jede von nicht mehr als ein paar Elektronen besetzt werden kann.
In der Regel wird die elektronische Konfiguration verwendet, um die Orbitale eines Atoms in seinem grundlegenden Zustand zu beschreiben, kann aber auch ein Atom verwendet werden.
Viele der physikalischen und chemischen Eigenschaften der Elemente können mit ihren einzigartigen elektronischen Konfigurationen korreliert werden. Valencia -Elektronen, Elektronen in der äußersten Schicht, sind der entscheidende Faktor für die einzigartige Chemie des Elements.
Wenn Elektronen der äußersten Schicht eines Atoms Energie von irgendeiner Art erhalten, bewegen sie sich zu größeren Energieschichten. Somit wird ein Elektron in der K -Schicht auf die Schicht L übertragen, die sich in einem Zustand der größten Energie befindet.
Wenn das Elektron in seinen grundlegenden Zustand zurückkehrt, füllt es die Energie, die es durch Emission eines elektromagnetischen Spektrums (Licht) absorbiert, freigegeben. Da jedes Atom über eine spezifische elektronische Konfiguration verfügt, verfügt es auch über ein spezifisches Spektrum, das als Absorptions- (oder Emissions-) Spektrum bezeichnet wird.
Aus diesem Grund wird der Begriff spektrale Notation verwendet, um auf die elektronische Konfiguration zu verweisen.
So bestimmen Sie die spektrale Notation: Quantenzahlen
Insgesamt werden vier Quantenzahlen verwendet, um die Bewegung und die Trajektorien jedes Elektrons in einem Atom vollständig zu beschreiben.
Die Kombination aller Quantenzahlen aller Elektronen in einem Atom wird durch eine Wellenfunktion beschrieben, die der Schrödinger -Gleichung erfüllt. Jedes Elektron in einem Atom hat einen einzigartigen Satz von Quantenzahlen.
Es kann Ihnen dienen: Molarenfraktion: Wie es berechnet wird, Beispiele, ÜbungenNach Paulis Ausschlussprinzip können zwei Elektronen nicht die gleiche Kombination von vier Quantenzahlen teilen.
Quantenzahlen sind wichtig, da sie verwendet werden können, um die elektronische Konfiguration eines Atoms und die wahrscheinliche Position der Atomelektronen zu bestimmen.
Quantenzahlen werden auch verwendet, um andere Eigenschaften von Atomen wie Ionisationsenergie und Atomradius zu bestimmen.
Quantenzahlen bezeichnen spezifische Schalen, Subkaps, Orbitale und Elektronen -Kurven.
Dies bedeutet, dass sie die Eigenschaften eines Elektrons in einem Atom vollständig beschreiben, dh jede einzelne Lösung für die Schrödinger -Gleichung oder die Wellenfunktion, Elektronen in einem Atom.
Es gibt insgesamt vier Quantenzahlen: die Hauptquantennummer (n), die Quantenzahl der Orbitalwinkel (L), die magnetische Quantenzahl (ml) und die Quantenzahl des Elektronenspin (MS).
Die Hauptquantenzahl NN beschreibt die Energie eines Elektrons und den wahrscheinlichsten Abstand des Kernelektrons. Mit anderen Worten, es bezieht sich auf die Größe des Orbitals und den Energieniveau, in dem ein Elektron platziert wird.
Die Anzahl der Unterkappen oder LL beschreibt die Form des Orbitals. Es kann auch verwendet werden, um die Anzahl der Winkelknoten zu bestimmen.
Die magnetische Quantenzahl ML beschreibt die Energieniveaus in einem Subkap und bezieht.
Aufbau -Prinzip
Aufbau kommt aus dem deutschen Wort Aufbauen, Was bedeutet "Build". Im Wesentlichen bauen wir beim Schreiben von Elektronenkonfigurationen Elektronenorbitale, während wir von einem Atom zum anderen voranschreiten.
Wenn wir die elektronische Konfiguration eines Atoms schreiben, werden wir die Orbitale in zunehmender Reihenfolge der Atomzahl füllen.
Das Aufbau -Prinzip stammt aus Paulis Ausschlussprinzip, das besagt, dass es in einem Atom keine zwei Fermionen (zum Beispiel Elektronen) gibt.
Es kann Ihnen dienen: Buttersäure: Formel, Eigenschaften, Risiken und VerwendungSie können den gleichen Satz von Quantenzahlen haben, daher müssen sie auf höheren Energieniveaus "akkumulieren". Wie sich Elektronen ansammeln, ist ein Thema der Elektroneneinstellungen.
Die stabilen Atome haben so viele Elektronen wie die Protonen im Kern. Die Elektronen versammeln sich in Quantenorbitalen um den Kern nach vier Grundregeln, die als AUFBAU -Prinzip bezeichnet werden.
1. Es gibt keine zwei Elektronen im Atom, die dieselben vier Quantenzahlen n, l, m und s teilten.
2. Elektronen werden zunächst die Orbitale der niedrigsten Energieniveau belegen.
3. Die Elektronen füllen die Orbitale immer mit der gleichen Spin -Nummer. Wenn die Orbitale voll sind, beginnt sie.
4. Elektronen füllen Orbitale für die Summe der Quantennummern n und l. Orbitale mit gleichen Werten (n + l) werden zuerst mit niedrigeren N -Werten gefüllt.
Die zweite und vierte Regeln sind im Grunde die gleichen. Ein Beispiel für Regel vier wären Orbitale 2p und 3s.
Ein Orbital 2p ist n = 2 und l = 2 und ein 3S -Orbital ist n = 3 und l = 1. (N + l) = 4 in beiden Fällen, aber das 2p -Orbital hat die niedrigste Energie oder einen niedrigeren Wert und wird vor Schicht 3s gefüllt.
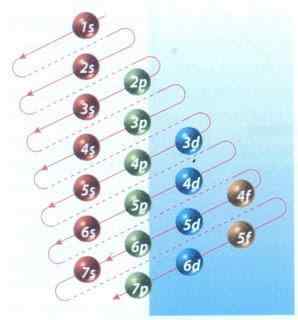 Abbildung 2: Moeller -Diagramm der elektronischen Konfigurationsfüllung
Abbildung 2: Moeller -Diagramm der elektronischen Konfigurationsfüllung Glücklicherweise können Sie das in Abbildung 2 gezeigte Moeller -Diagramm verwenden, um die Elektronen zu füllen. Das Diagramm wird gelesen, indem die Diagonalen aus 1s ausgeführt werden.
Abbildung 2 zeigt Atomorbitale und Pfeile zeigen den Weg an, um zu folgen.
Jetzt, da bekannt ist, dass die Reihenfolge der Orbitale gefüllt ist, ist das einzige, was bleibt.
Orbitale haben einen möglichen Wert von ml 2 Elektronen enthalten
P -Orbitale haben 3 mögliche Werte von ml 6 Elektronen enthalten
Orbitale haben 5 mögliche Werte von ml 10 Elektronen enthalten
F -Orbitale haben 7 mögliche Wertel 14 Elektronen enthalten
Dies ist alles, was erforderlich ist, um die elektronische Konfiguration eines stabilen Atoms eines Elements zu bestimmen.
Kann Ihnen dienen: Dodecil Natriumsulfat (SDS): Struktur, Eigenschaften, verwendetNehmen Sie zum Beispiel das Stickstoffelement. Stickstoff hat sieben Protonen und damit sieben Elektronen. Das erste Orbital ist das Orbital 1S. Ein Orbital S hat zwei Elektronen, so dass noch fünf Elektronen übrig sind.
Das nächste Orbital ist das 2S -Orbital und enthält die nächsten beiden. Die drei endgültigen Elektronen gehen zum 2P -Orbital, das bis zu sechs Elektronen enthalten kann.
Sinkregeln
In dem Abbbau -Abschnitt wurde erläutert, wie Elektronen zuerst die niedrigsten Energieorbitale ausfüllen und dann zu den höchsten Energieorbitalen wechseln, nachdem die Orbitale der niedrigeren Energie in vollem Umfang voll sind.
Es gibt jedoch ein Problem mit dieser Regel. Sicherlich müssen 1S -Orbitale vor 2S -Orbitalen gefüllt werden, da 1s -Orbitale einen niedrigeren Wert von n und daher eine niedrigere Energie haben.
Und die drei verschiedenen Orbitale? In welcher Reihenfolge sollten sie gefüllt werden? Die Antwort auf diese Frage beinhaltet die Sink -Regel.
Die Sink -Regel legt fest, dass:
- Jedes Orbital in einem Sub -Level ist einzeln besetzt, bevor ein Orbital doppelt besetzt ist.
- Alle Elektronen in individuell besetzten Orbitalen haben die gleiche Kurve (um die Gesamtdrehung zu maximieren).
Wenn Orbitale Elektronen zugeordnet werden, versucht ein Elektron zunächst, alle Orbitale mit ähnlicher Energie (auch degenerierte Orbitale bezeichnet) zu füllen, bevor sie mit einem anderen Elektron in einem halben Umlaufbahn übereinstimmt.
Atome in den Erdenzuständen haben dazu neigen, so viele Elektronen wie möglich nicht zu sehen. Überlegen Sie, wie Elektronen das gleiche Verhalten wie die gleichen Pole in einem Magneten aufweisen, wenn sie sich in Verbindung setzen.
Wenn negativ geladene Elektronen die Orbitale füllen, versuchen sie zunächst, so viel wie möglich davonzukommen, bevor sie übereinstimmen müssen.
Verweise
- Quantenzahlen. Chem erholt sich.Librettexts.Org.
- Elektronenkonfigurationen und die Eigenschaften von Atomen (s.F.). Von Oneonta geborgen.Edu.
- Elektronische Konfiguration. Von Britannica geborgen.com.

