Degenerierte Orbitale

- 1448
- 245
- Tizian Liebich
 Energieschema mit den Orbitalen, die von fehlenden Elektronen besetzt sind. Quelle: Gabriel Bolívar
Energieschema mit den Orbitalen, die von fehlenden Elektronen besetzt sind. Quelle: Gabriel Bolívar Der Degenerierte Orbitale Sie sind diejenigen, die auf dem gleichen Energieniveau gefunden werden. Nach dieser Definition müssen sie die gleiche Hauptquantenzahl haben N. Somit werden 2S- und 2p -Orbitale degeneriert, da sie zum Energieniveau 2 gehören, obwohl bekannt ist, dass ihre Funktionen von Winkel- und Radialwellen unterschiedlich sind.
Als die Werte von N, Elektronen beginnen, andere Energie -Sub -Levels wie D- und F -Orbitale zu besetzen.
Jedes dieser Orbitale hat ihre eigenen Eigenschaften, die auf den ersten Blick in ihren Winkelformen beobachtet werden. Dies sind die kugelförmigen Figuren (s) von Hanteln (P) von Kleeblättern (D) und kugelförmiger (f).
Unter ihnen gibt es einen Energieunterschied, selbst wenn es zu demselben Niveau gehört N.
Beispielsweise wird im oberen Bild (ein abnormaler Fall) ein Energieschema mit den Orbitalen angezeigt, die von fehlenden Elektronen (ein abnormaler Fall) besetzt sind (ein abnormaler Fall).
Es ist zu sehen, dass von allen das stabilste (die geringste Energie) das NS -Orbital (1s, 2s, ...) ist, während der NF am instabilsten ist (der mit der größten Energie).
Degenerierte Orbitale eines isolierten Atoms
Degenerierte Orbitale mit dem gleichen Wert wie N, Sie sind in einem Energieschema in der gleichen Linie.
Aus diesem Grund befinden sich die drei roten Streifen, die die Orbitale P symbolisieren, in derselben Linie; wie die gleichen Weise die lila und gelben Streifen.
Das Bildschema verstößt gegen die Sink -Regel: Die Orbitale größerer Energie sind mit Elektronen gefüllt.
Können Ihnen dienen: Säuren und Basen: Unterschiede, Eigenschaften, BeispieleWenn die Elektronen sich paaren, verliert das Orbital Energie und übt eine größere elektrostatische Abstoßung auf die fehlenden Elektronen der anderen Orbitale aus.
Solche Effekte werden jedoch in vielen Energiediagrammen nicht berücksichtigt. Wenn ja, und die Senkenregel befolgen, ohne die Orbitale D vollständig zu füllen.
Wie oben erwähnt, hat jedes Orbital seine eigenen Eigenschaften. Ein isoliertes Atom mit seiner elektronischen Konfiguration ist bereit, seine Elektronen in der genauen Anzahl von Orbitalen zu erhalten.
Nur die Energie in Energie können als degeneriert angesehen werden.
Orbitale p
Die drei roten Streifen für die Orbitale des Bildbildes zeigen, dass beide pX, PUnd Und Pz Sie haben die gleiche Energie.
In jedem ist ein Elektron verschwunden, das durch vier Quantenzahlen beschrieben wird (N, l, ml Und MS), während die ersten drei die Orbitale beschreiben.
Der einzige Unterschied zwischen ihnen wird durch den magnetischen Moment bezeichnet ml, das zieht die Flugbahn von pX Auf einer x -Achse, pUnd auf der yachse und pz auf der Z -Achse.
Die drei sind gleich, aber sie unterscheiden sich nur in ihren räumlichen Orientierungen. Aus diesem Grund werden sie immer in Energie gezogen, dh degeneriert.
Ebenso wie das gleiche, ein inomotives Stickstoffatom (mit 1S -Konfiguration22s22 p3) Sie müssen Ihre drei Orbitale degeneriert halten. Das Energieszenario ändert sich jedoch abrupt, wenn es in einem chemischen Molekül oder einer Verbindung als Atom von N angesehen wird.
Es ist so, weil pX, PUnd Und Pz Sie sind in der Energie gleich. Dies kann in jedem von ihnen variieren, wenn sie unterschiedliche chemische Umgebungen haben. Das heißt, wenn sie mit verschiedenen Atomen verbunden sind.
Kann Ihnen dienen: Isopreno: Struktur, Eigenschaften, AnwendungenOrbitale d
Die fünf lila Streifen bezeichnen die Orbitale d. In einem isolierten Atom, auch wenn sie gepaarte Elektronen haben, werden diese fünf Orbitale degeneriert. Im Gegensatz zu den P -Orbitalen gibt es diesmal jedoch einen deutlichen Unterschied in ihren Winkelformen.
Daher bewegt sich ihre Elektronen Anweisungen im Raum, die von einem Orbital d zum anderen variieren.
Dies verursacht laut dem Kristalline Feldtheorie, dass eine minimale Störung a verursacht a Energie entfalten der Orbitale; Das heißt, die fünf lila Streifen trennen eine Energielücke zwischen ihnen:
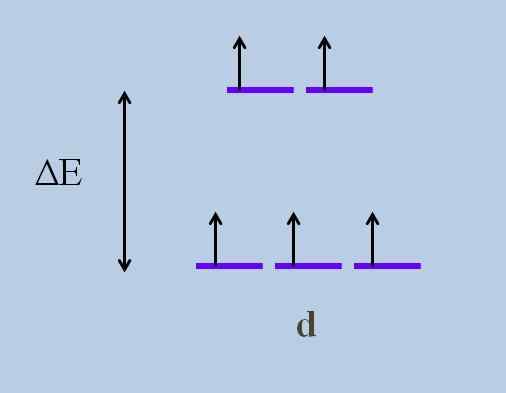 Energieentwicklungsschema der Orbitale. Quelle: Gabriel Bolívar
Energieentwicklungsschema der Orbitale. Quelle: Gabriel Bolívar Was sind die Orbitale oben und welche sind die folgenden? Die oben genannten werden symbolisiert als UndG, und die unten T2 g.
Beachten Sie, wie anfänglich alle lila Streifen ausgerichtet waren und jetzt zwei Orbitale gebildet wurden UndG mehr Energie als der andere Satz von drei Orbitalen T2 g.
Diese Theorie ermöglicht es, die D-D-Übergänge zu erklären, zu denen viele der Farben in den Verbindungen der Übergangsmetalle beobachtet werden (Cr, Mn, Glauben usw. werden vergeben.).
Diese elektronische Störung ist auf die Koordinationswechselwirkungen des Metallzentrums mit anderen Molekülen zurückzuführen Liganden.
Orbitale f
Und mit den Orbitalen F, den sieben gelben Streifen, ist die Situation weiter kompliziert. Die räumlichen Adressen variieren stark zwischen ihnen, und die Visualisierung ihrer Verbindungen wird zu komplex.
In der Tat wird angenommen, dass Orbitale F von einer solchen internen Schicht sind, dass sie an der Bildung von Links nicht „merklich teilnehmen“.
Es kann Ihnen dienen: Perchloroxid (Cl2O7)Wenn das mit den Orbitalen isolierte Atom von anderen Atomen umgeben ist, beginnen Wechselwirkungen und Entfaltung (Degenerationsverlust):
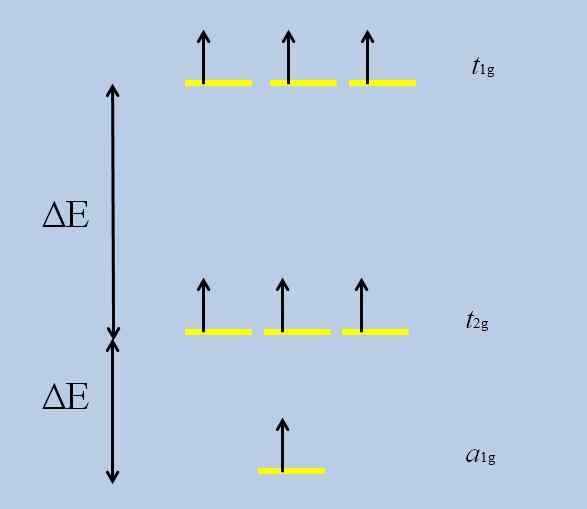 Schema des Degenerationsverlusts. Quelle: Gabriel Bolívar
Schema des Degenerationsverlusts. Quelle: Gabriel Bolívar Beachten Sie, dass die gelben Streifen nun drei Sätze bilden: T1g, T2 g Und Zu1g, Und sie sind nicht mehr entartet.
Degenerierte hybride Orbitale
Es wurde gesehen, dass sich Orbitale entfalten und Degeneration verlieren können. Obwohl dies elektronische Übergänge erklärt, wird nicht klargestellt, wie und warum es unterschiedliche molekulare Geometrien gibt. Hier treten die Hybridorbitale ein.
Sein Hauptmerkmal ist, dass sie degeneriert sind. So entstehen sie aus der Mischung aus Orbitalfiguren S, P, D und F, um degenerierte Hybriden zu verursachen.
Zum Beispiel werden drei P -Orbitale mit einem S gemischt, um vier SP -Orbitale zu geben3. Alle SP -Orbitale3 Sie sind degeneriert und haben daher die gleiche Energie.
Wenn zusätzlich zwei Orbitale mit den vier SP gemischt werden3, Es werden sechs Orbitale erhalten3D2.
Und wie erklären molekulare Geometrien? Da es sechs mit gleichen Energien gibt, müssen sie folglich symmetrisch im Raum geführt werden, um gleiche chemische Umgebungen zu erzeugen (z. B. in einer MF -Verbindung6).
Wenn sie dies tun, wird ein Oktaeder der Koordination gebildet, das einer oktaedrischen Geometrie um ein Zentrum (m) entspricht.
Geometrien weisen jedoch normalerweise Verzerrungen auf, was bedeutet, dass selbst hybride Orbitale nicht vollständig degeneriert sind.
Daher existieren degenerierte Orbitale als Schlussfolgerung nur in isolierten Atomen oder stark symmetrischen Umgebungen.
Verweise
- Definition von Ablagerung. Erholt von: Chemicoolool.com
- Atome und Atomorbitale. Von Sparknotes geborgen.com
- Whitten, Davis, Peck & Stanley. Chemie. (8.ª ed.). Cengage Lernen.

