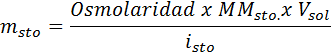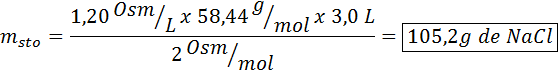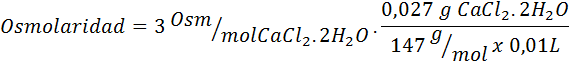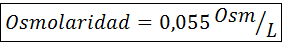Osmolarität
- 1212
- 265
- Jasmine Kupprion
Was ist Osmolarität?
Der Osmolarität Es handelt sich um eine Konzentrationseinheit, die die molare Konzentration des Satzes von osmotisch aktiven Partikeln in einer Lösung anzeigt. Mit anderen Worten, Osmolarität ist die Molarität von osmotisch aktiven Partikeln.
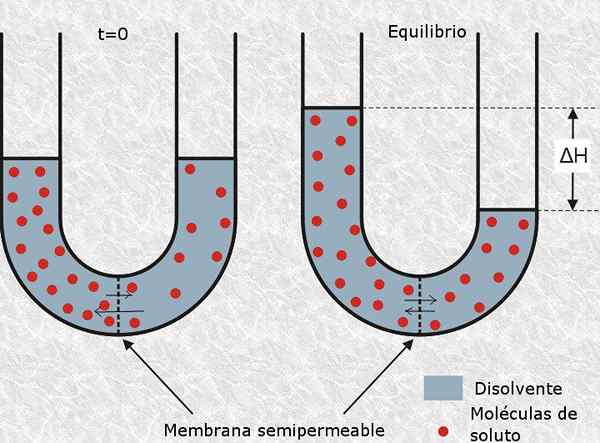
ist definiert als osmotisch aktives Teilchen zu diesem neutralen oder Ionenmolekül, das eine semipermeable Membran wie die Zellmembran nicht überqueren kann. Das Vorhandensein dieser Art von Partikeln erzeugt osmotischen Druck in der Lösung und daher ihr Name.
Die Anzahl der Mol osmotisch aktiven Partikel wird genannt Osmoles (dargestellt durch das OSM -Symbol), so dass die Osmolarität in Einheiten von exprimiert wird Osm/l.
Die Bedeutung der Osmolarität
Die Osmolarität ist ein Konzept von großer Bedeutung für Biologie und Medizin, da das osmotische Gleichgewicht von Zellen mit ihrer Umgebung für ihr Überleben von wesentlicher Bedeutung ist. Beispielsweise kann die Injektion einer Lösung mit einer sehr hohen oder sehr niedrigen Osmolarität intravenös leicht zu Tod für einen Patienten führen.
 Osmolarität ist ein wesentlicher Aspekt von Lösungen in der Medizin und Biologie
Osmolarität ist ein wesentlicher Aspekt von Lösungen in der Medizin und Biologie Andererseits ist eine sehr häufige Technik, mit der Zellbiologen Zellen verschiedener Typen brechen. Dies besteht darin, die Zellen in eine hypotonische Lösung (mit einer sehr geringen Osmolarität) zu bringen, damit das Wasser der Lösung sie durch Osmose durchdringt und sie platzt.
Dies macht es sowohl für Ärzte als auch für Biologen und Fachkräfte aus anderen Bereichen sehr wichtig, die wissen, messen oder wissen, wie die Osmolarität einer Lösung berechnet werden kann.
Kann Ihnen dienen: prozentuale KonzentrationUnterschiede zwischen Osmolarität und Osmolalität
Wenn Sie über Osmolarität sprechen, ist es auch notwendig, über Osmolalität zu sprechen. Die Osmolalität ähnelt der Osmolarität, genauso wie die Moral der Molarität ähnlich ist.
Während die Osmolarität die angibt Anzahl der Osmolen pro Liter Lösung (OSM/L), Die Osmolalität zeigt dasselbe, aber Für jedes Kilogramm Lösungsmittel (OSM/kg).
Die Osmolalität hat den Vorteil, dass es nicht abhängig vom Volumen der Lösung und nicht von der Dichte oder Temperatur abhängt. Aus diesem Grund hat eine Lösung die gleiche Osmolalität bei 25 ° C wie bei 37 ° C. Andererseits wird seine 37 ° C -Osmolarität aufgrund des Anstiegs des thermischen Expansionsvolumens bei 25 ° C geringfügig niedriger sein als die Osmolarität.
Die Osmolaralität ist in der Regel experimentell als Osmolarität leichter zu messen. Osmolarität ist jedoch leichter zu berechnen und eine einfachere Einheit zu arbeiten, wenn Verdünnungen erstellt werden.
Wie wird die Osmolarität einer Lösung berechnet??
Es gibt verschiedene Möglichkeiten, die Osmolarität einer Lösung zu berechnen, abhängig von den angezeigten Informationen, die gezählt werden. Es kann berechnet werden aus:
- Die Mengen an gelösten und Lösung.
- Die Molarität der vorhandenen gelösten gelösten Stoffe.
- Individuelle Ionenkonzentrationen.
- Unter anderem der Prozentsatz m/v der gelösten Stoffe.
In allen Fällen basiert die Berechnung auf der allgemeinen Formel der Osmolarität, nämlich:

Wo NOSM Es ist die Anzahl der in der Lösung vorhandenen Osmolen und VSonne Es ist das Volumen desselben in Litern ausgedrückt. Die Anzahl der Osmolen wird berechnet, indem die Anzahl der Mol im gelösten Stoff durch die Anzahl der Partikel multipliziert wird, in denen sie in Lösung dissoziiert.
Kann Ihnen dienen: heterogene Gemische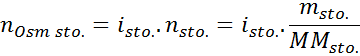
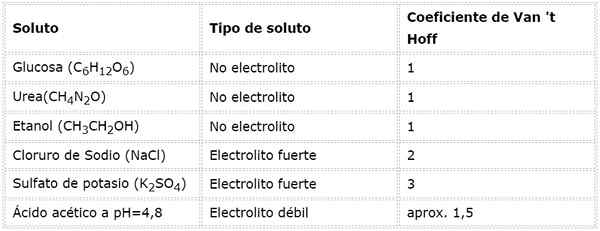
In dieser Gleichung, NSto Es ist die Anzahl der Maulwürfe von gelösten Stoff, MSto ist seine Masse (in g), MmSto Es ist seine Molmasse (in g/mol) und seine Molmasse YoSto Es ist der Koeffizient von Van 't Hoff des gelösten Stoffes. Dieser Koeffizient hat einen Wert von 1 für Nicht -Elektrolyte gelöste Stoffe (Zum Beispiel wie Glukose).
Für starke Elektrolyte, die vollständig dissoziiert sind (wie Natriumchlorid, NaCl).
Zum Beispiel im Fall von Kaliumsulfat k2SW4, deren Dissoziationsreaktion ist:
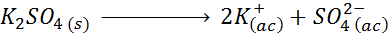
Jedes Mol des Salzes, das sich auflöst+ Und 1 so Ion42-), somit I = n = 3.
Bei schwachen Elektrolyten ist die Berechnung komplizierter, werden jedoch normalerweise experimentell bestimmt. Die folgende Tabelle fasst die Koeffizienten von Van 't Hoff für einige übliche gelöste Stoffe zusammen.
Beispiele zur Berechnung von Osmolarität
1. Beispiel 1
Bestimmen Sie die Osmolarität einer vorbereiteten Lösung, indem Sie 10 g NaCl und 10 g Glucose in 100 ml Lösung lösen
Lösung: In diesem Fall werden die Osmoles jedes gelösten Stoffes getrennt berechnet und dann hinzufügen. Die Molmassen betragen 58,45 g/mol bzw. 180 g/mol, und die Ve 'T -Hoffnungskoeffizienten betragen 2 und 1:
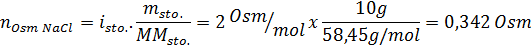
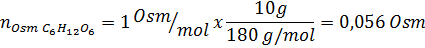
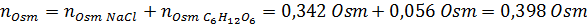
Jetzt berechnen wir die Osmolarität unter Verwendung der Formel und wissen, dass 100 ml 0,100 l entsprechen:
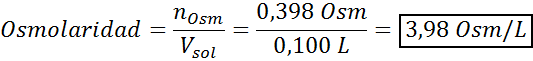
Schließlich beträgt die Osmolarität der Lösung 3,98 OSM/L.
2. Beispiel 2
Bestimmen Sie die Osmolarität eines Kaliumsulfat -Molaren von 0,05 Lösung.
Lösung: Wenn wir bereits die Molarität des gelösten Stoffs kennen, ist die Berechnung der Osmolarität so einfach wie die Multiplikation dieser Konzentration mit dem Van 't Hoff -Faktor.
Kann Ihnen dienen: Benzaldehyd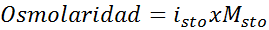
In diesem Fall beträgt der Salzfaktor 3.
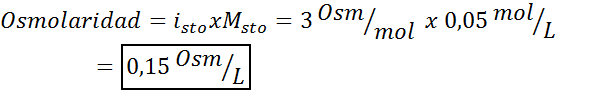
3. Beispiel 3
Bestimmen Sie die Osmolarität einer Plasmaprobe, die 0,125 m Natriumionen, 0,020 M Kaliumionen und 0,145 Chloridionen enthält.
Lösung: Die Osmolarität der einzelnen Ionen entspricht ihrer Molarität, da die Ionen nicht mehr dissoziieren und a haben I = 1. Aus diesem Grund ist es in diesem Fall nur notwendig, sich mit zu multiplizieren I = 1 Jede Konzentration und hinzufügen:
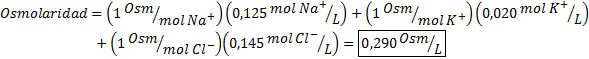
4. Beispiel 4
Berechnen Sie die Osmolarität einer Lösung mit 27 mg CAP2.2H2Oder für jeweils 10 ml Lösung
Lösung: Das Cochl -Molekulargewicht2.2H2Oder es ist 147 g/mol. Beim Auflösen wird dieses Salz in 2 Wassermoleküle und drei Ionen getrennt. Wassermoleküle sind jedoch keine osmotisch aktiven Partikel, daher werden sie nicht für die Berechnung der Osmolarität berücksichtigt, und der Koeffizient für diese Verbindung beträgt 3 3.

5. Beispiel 5
Welche Masse von Natriumchlorid ist erforderlich, um 3 Liter einer Lösung vorzubereiten, deren Osmolarität 1,20 OSM/L beträgt?
Lösung: In diesem Fall reicht es ausreichend, die Masse der Osmolaritätsformel zu löschen, wenn die Masse des gelösten Stoffs angefordert wird und wir das Volumen und die Konzentration haben.