Calciumoxalat (CAC2O4) Eigenschaften, Struktur, Verwendungen, Risiken
- 5038
- 1014
- René Riediger
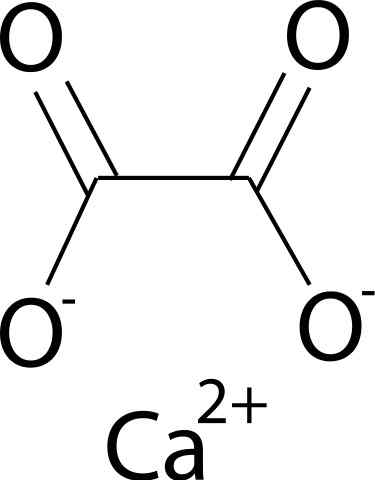
Er Kalziumoxalat Es handelt sich um eine organische Verbindung, die durch Kohlenstoff- (C), Sauerstoff (O) und Calcium (Ca) Elemente (CA) (CA) gebildet wird. Seine chemische Formel ist CAC2ENTWEDER4. Es wird im Allgemeinen in seinen drei hydratisierten Formen gefunden: Mono-, Di- und Trihydrat. Dies ist mit einem, zwei oder drei Wassermolekülen in seiner kristallinen Struktur.
Calciumoxalat tritt in Mineralien, Pflanzen, Pilzen und anderen Lebewesen wie Säugetieren und sogar bei Menschen infolge des Stoffwechsels einiger Proteine vor. Es kann im Urin von Menschen und einigen Tieren gefunden werden.
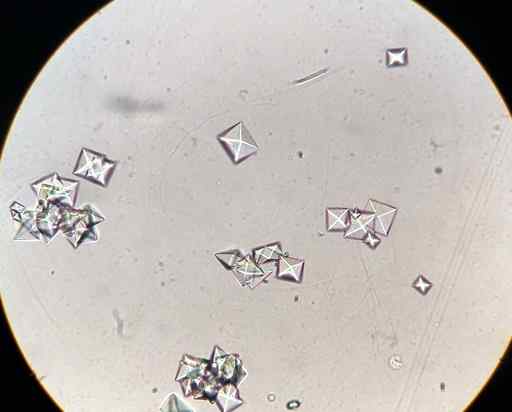 CAC Calciumoxalatkristalle2ENTWEDER4 In einer mit einem Mikroskop beobachteten Urinprobe. J3D3/CC BY-SA (https: // creativeCommons.Org/lizenzen/by-sa/4.0). Quelle: Wikimedia Commons.
CAC Calciumoxalatkristalle2ENTWEDER4 In einer mit einem Mikroskop beobachteten Urinprobe. J3D3/CC BY-SA (https: // creativeCommons.Org/lizenzen/by-sa/4.0). Quelle: Wikimedia Commons. Einige Lebensmittel wie Spinat, Ruibarbos, Soja.
Sie können das Aussehen von CAC -Steinen vermeiden2ENTWEDER4 In den Nieren, wenn viele Flüssigkeiten aufgenommen werden, insbesondere Wasser, die Lebensmittel mit hohem Oxalatgehalt vermeiden und diejenigen verbrauchen, die reich an Kalzium und Magnesium sind.
Calciumoxalat bildet unerwünschte Inlays in Rohren und Prozesstanks wie Zellstoff- und Papierherstellung sowie in Bierfabriken.
[TOC]
Struktur
Calciumoxalat wird durch das Calcium -Ca -Ion gebildet2+ und das Oxalation c2ENTWEDER42-. Oxalatanion besteht aus zwei Kohlenstoffatomen und vier Sauerstoffatomen. Die negativen Lasten von Oxalatanionen sind in Sauerstoffatomen vorhanden.
 Chemische Struktur von Calciumoxalat. Vsimonian/cc By-SA (https: // creativecommons.Org/lizenzen/by-sa/2.5). Quelle: Wikimedia Commons.
Chemische Struktur von Calciumoxalat. Vsimonian/cc By-SA (https: // creativecommons.Org/lizenzen/by-sa/2.5). Quelle: Wikimedia Commons. Nomenklatur
- Kalziumoxalat
- Oxalsäure -Kalziumsalz
- Etanodiosäure Kalziumsalz
Eigenschaften
Körperlicher Status
Farblose kristalline, weiße, gelbe oder braune, die in drei verschiedenen hydratisierten Formen vorliegen können.
Molekulargewicht
128,1 g/mol
Schmelzpunkt
Calciumoxalatmonohydrat zersetzt sich auf 200 ° C.
Bestimmtes Gewicht
CAC -Monohydrat2ENTWEDER4 •H2O = 2,22 g/cm3
CAC Dihydrat2ENTWEDER4 •2H2O = 1,94 g/cm3
CAC -Trihydrat2ENTWEDER4 •3H2O = 1,87 g/cm3
Löslichkeit
Fast unlöslich in Wasser: 0,00061 g/100 g Wasser bei 20 ° C. Monohydrat löst sich in verdünnter Säure auf.
pH
Wässrige Calciumoxalatlösungen sind schwach grundlegend.
Chemische Eigenschaften
Calciumoxalat ist das Calciumsalz von Oxalsäure. Dies ist ein natürliches sekundäres Produkt des Stoffwechsels, daher ist es im menschlichen Körper sehr häufig und ist Teil vieler Lebensmittel.
Oxalsäure und ihre konjugierte Base Oxalat sind sehr oxidierte organische Verbindungen mit einer starken Chelataktivität, dh sie können leicht mit positiven Ionen mit +2 oder +3 Lasten kombiniert werden.
Kann Ihnen dienen: Methyl- oder Metilo -GruppeSeine wässrigen Lösungen sind schwach grundlegend, weil das Oxalation tendenziell Protonen H nimmt+ von Wasser, das oh Ionen freigibt-. Nach zwei Protonen h+ Das Oxalation wird zu Oxalsäure H2C2ENTWEDER4:
C2ENTWEDER42- + H2O → HC2ENTWEDER4- + Oh-
HC2ENTWEDER4- + H2O → h2C2ENTWEDER4 + Oh-
Präsenz in der Natur
In Mineralien
Calciumoxalat ist das häufigste Oxalat und wird in Form von Mineralien als Whewellita, Weddellita und Caoxit präsentiert.
Whewellita ist CAC -Monohydrat2ENTWEDER4 •H2Oder und ist der stabilste für die Formen dieser Verbindung.
 Whewellita Mineral Rock. Rob Lavinsky, Irocks.com-c-by-sa-3.0/cc By-SA (https: // CreePecommons.Org/lizenzen/by-sa/3.0). Quelle: Wikimedia Commons.
Whewellita Mineral Rock. Rob Lavinsky, Irocks.com-c-by-sa-3.0/cc By-SA (https: // CreePecommons.Org/lizenzen/by-sa/3.0). Quelle: Wikimedia Commons. Die Weddellita ist das CAC Dihydrate2ENTWEDER4 •2H2O und ist weniger stabil als Monohydrat.
 Weddelit -Mineralkristalle. Leon Hupperichs/CC BY (https: // creativecommons.Org/lizenzen/bis/3.0). Quelle: Wikimedia Commons.
Weddelit -Mineralkristalle. Leon Hupperichs/CC BY (https: // creativecommons.Org/lizenzen/bis/3.0). Quelle: Wikimedia Commons. Caxita ist der Calciumoxalat -Trihydrado CAC2ENTWEDER4 •3H2ENTWEDER.
In Pflanzen und Pilzen
Calciumoxalat ist mit trockenen Böden und Blättern verbunden, auch mit Krankheitserregern, freien Symbiose oder Pflanzen, die mit Pflanzen verbunden sind. In letzterem werden Kristalle durch die Ausfällung von Calcium in Form seines Oxalats gebildet.
CAC -Bildung2ENTWEDER4 Für Pilze hat es einen wichtigen Einfluss auf die biologischen und geochemischen Prozesse von Böden, da es eine Kalziumreserve für das Ökosystem darstellt.
Gegenwart im menschlichen Körper und bei Säugetieren
Oxalat stammt aus der Leber, in den roten oder erythrozyten Blutzellen und in einer geringeren Menge in der Niere. Es bildet sich aus dem Metabolismus von Aminosäuren (wie Phenylalanin und Tryptophan) und durch Oxidation des Glioxal -Diadehyds,.
Vitamin C kann auch bei der Ausführung seiner Antioxidationsfunktion zu Oxalat werden.
Calciumoxalat findet sich in den Steinen, die in den Nieren von Menschen oder Tieren mit Nierenerkrankung gebildet werden.
Die sogenannten Calciumoxalatberechnungen oder -steine werden durch die Kristallisation oder Aggregation des CAC gebildet2ENTWEDER4 Im Gesamturin mit Kalzium und Oxalat. Dies bedeutet, dass Urin sowohl Kalzium als auch Oxalat enthält, dass es nicht möglich ist, dass diese Verbindung gelöst bleibt, aber ausfällt oder in den Festkörper in Form von Kristallen übergeht.
In Menschen
Die Bildung von Sand oder Steinen in den Nieren ist eine Krankheit, die als Nephrolithiasis bezeichnet wird. Es greift ungefähr 10% der Bevölkerung an und etwa 75% dieser Steine bestehen aus Calciumoxalat -CAC2ENTWEDER4.
 Calciumoxalat kann in den Nieren Steine bilden. Autor: VSRAO. Quelle: Pixabay.
Calciumoxalat kann in den Nieren Steine bilden. Autor: VSRAO. Quelle: Pixabay. Die Bildung und das Wachstum von Calciumoxalatkristallen in der Niere treten auf, da bei einigen Menschen der Urin mit dem Salz übersättigt ist. Calciumoxalat entwickelt sich im sauren Urin im pH -Wert von weniger als 6,0.
Kann Ihnen dienen: IsóbarosDie Supaturation tritt auf, wenn die Ausscheidung oder Eliminierung dieses Salzes (das im Wasser sehr wenig löslich ist) durch den Urin in einem kleinen Wasservolumen auftritt.
Faktoren, die das Aussehen von Nierensteinen beeinflussen
Zu den Faktoren, die die Bildung von Calciumoxalatsand begünstigen.
Überschüssiges Oxalat kann auftreten, wenn unter anderem hohe Mengen an Spinat, Rough, Soja, Nüssen und Schokolade aufgenommen werden.
 Schokolade kann eine Quelle für Kalziumoxalat sein und das Aussehen von Steinen in den Nieren bevorzugen. Autor: Alexander Stein. Quelle: Pixabay.
Schokolade kann eine Quelle für Kalziumoxalat sein und das Aussehen von Steinen in den Nieren bevorzugen. Autor: Alexander Stein. Quelle: Pixabay. Es gibt jedoch Substanzen, die die Bildung von Steinen hemmen oder verhindern. Unter den Verbindungen, die Berechnungen vermeiden.
Möglichkeiten, die Bildung von Calciumoxalatsteinen zu vermeiden
Eine gute Strategie zur Verhinderung von Sandrezidiven oder Calciumoxalatberechnungen, einschließlich der Zunahme der Flüssigkeitsaufnahme, einer Erhöhung der kalziumreichen Lebensmittel (wie Milchprodukte) und dem Einschränkung von Tischsalz (NaCl), tierischem Protein, tierischem Protein und reichhaltigen Mahlzeiten in Oxalat.
Bei Tieren
Seit Anfang des Jahres 2000. Es scheint, dass dies von der Art der Nahrung abhängt, die diese Tiere aufnehmen und mit der Säure von Urin und Magnesiummangel (Mg) zu tun haben.
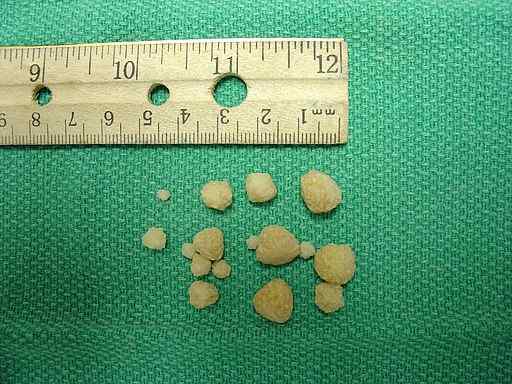 Calciumoxalatsteine in der Harnblase eines Hundes gefunden. Joel Mills/CC BY-SA (http: // creativecommons.Org/lizenzen/by-sa/3.0/). Quelle: Wikimedia Commons.
Calciumoxalatsteine in der Harnblase eines Hundes gefunden. Joel Mills/CC BY-SA (http: // creativecommons.Org/lizenzen/by-sa/3.0/). Quelle: Wikimedia Commons. Körperreaktion auf überschüssiges Oxalat
Es gibt Hinweise darauf, dass sowohl Menschen als auch Tiere auf überschüssiges Oxalat reagieren, indem sie die Anzahl der Bakterien erhöht, die Oxalat beeinträchtigen können.
Einige dieser Bakterien sind Oxalobacter -Formene, Bifidobacterium sp., Porphyromonas Gingivalis Und Bacillus sp., unter anderem und sind natürlich im Darm vorhanden.
Anwendungen
Gemäß den konsultierten Quellen wird Calciumoxalat in der Keramikbeschichtung verwendet.
Es wurde verwendet, um Skulpturen und andere künstlerische Elemente des Kalksteins abzudecken, und es wurde festgestellt.
 In Italien wurde es erlebt, um Objekte Kalkstein von Museen mit Calciumoxalat abzudecken, um sie zu erhalten. Autor: Quelle: Moni Quayle. Pixabay.
In Italien wurde es erlebt, um Objekte Kalkstein von Museen mit Calciumoxalat abzudecken, um sie zu erhalten. Autor: Quelle: Moni Quayle. Pixabay. Probleme in einigen Prozessen
In der Zellstoff- und Papierindustrie kann Calciumoxalat Inlays bilden, die viele Probleme im Prozess verursachen.
Um seine Bildung in Industrieprozesskanälen oder Rohren zu vermeiden.
Es kann Ihnen dienen: Kobaltchlorid (COCL2 (: Struktur, Nomenklatur, EigenschaftenEs neigt auch dazu, sich als Stein in den Behältern zu sammeln, in denen Bier hergestellt wird, wo es beseitigt werden muss, um die Bildung von Mikroorganismen zu vermeiden, die dem Trinken einen unangenehmen Geschmack verleihen können.
Risiken
In hohen Konzentrationen kann Oxalat bei Tieren und gelegentlich beim Menschen zu Tod führen.
Die Akkumulation von Oxalat und seiner konjugierten Säure Oxalsäure kann Störungen wie Herzfehlfunktion, Calciumoxalatsteine, Nierenversagen und sogar Tod durch Toxizität verursachen.
Verweise
- Glasauer, s.M. et al. (2013). Metalle und Metalloide, Transformation durch Mikroorganismen. Oxalate. In Referenzmodulation in Erdsystemen und Umweltwissenschaften. Von Scientedirect erholt.com.
- Baumann, j. M. und Casella, r. (2019). Prävention von Calciumnephrolithiasis: Der Einfluss der Diurese auf die Calciumoxalatkristallisation im Urin. Adv Previum, 2019; 2019: 3234867. NCBI erholte sich.NLM.NIH.Regierung.
- Breshears, m.ZU. und übertragen, zu.W. (2017). Das Harnsystem. Calciumoxalatrechnung. In pathologischer Basis von Veterinärerkrankungen (sechste Ausgabe). Von Scientedirect erholt.com.
- Huang und. er al. (2019). TGE -Handhabung von Oxalat im Körper und TGE -Ursprung von Oxalat in Calciumoxalatstonen. Urol int, 2019 Dez 5: 1-10. NCBI erholte sich.NLM.NIH.Regierung.
- Nilvebrant, n.-ENTWEDER. et al. (2002). Biotechnologie in der Zellstoff- und Papierindustrie. In der Biotechnologie in Arbeit. Von Scientedirect erholt.com.
- Pahira, J.J. Und Pevzner, m. (2007). Nephrolithiasis. Kalziumsteine. In Penn klinisches Handbuch der Urologie. Von Scientedirect erholt.com.
- Worcester, e. M. (1994). Calciumoxalat -Kristallwachstumsinhibitoren im Urin. J Am Soc Nephrol 1994 Nov; 5 (5 Suppl 1): S46-53). Von jasn geborgen.Asnjournals.Org.
- Finkielstein, v.ZU. und Goldfarb, D.S. (2006). Strategien zur Verhinderung von Kalziumoxalatsteinen. NCBI erholte sich.NLM.NIH.Regierung.
- ODER.S. Nationalbibliothek für Medizin. (2019). Kalziumoxalat. Aus Pubchem geborgen.NCBI.NLM.NIH.Regierung.
- Peck, a.B. et al. (2015). Oxalat-sich auf Mikroorganismen oder Oxalat-Abbau-Enzyme: Wich ist die zukünftige Therapie für die enzymatische Auflösung von Calciumoxalat-Urolithen bei wiederkehrenden Steinkrankungen? Urolithiasis, 2016 Februar; 44 (1): 27-32. NCBI erholte sich.NLM.NIH.Regierung.
- Holames, r.P. et al. (2016). Senkung der Oxalatausscheidung im Urin, um Calciumoxalatstein -Diepar zu dekretisieren. Urolithiasis. 2016 Februar; 44 (1); 27-32. NCBI erholte sich.NLM.NIH.Regierung.
- Cyzar, t.M. (1998). Calciumoxalat: Eine Oberflächenbehandlung für Kalkstein. Journal of Conservation and Museum Studies 4, S.6-10. Abgerufen von JCMS-Journal.com.
- Wikimedia (2019). Kalziumoxalat. Abgerufen von.Wikipedia.Org.
- « Qualitative Forschungsmerkmale, Typen, Techniken, Beispiele
- Funktionalismus (Psychologie) Ursprung, Merkmale und Autorenvertreter »

