Natriumoxalat (Na2C2O4) Struktur, Eigenschaften, Verwendungen, Risiken

- 5136
- 1465
- Tizian Liebich
Er Natriumoxalat Es ist eine organische Verbindung, die von zwei Natriumionen und einem Oxalation gebildet wird. Seine chemische Formel ist na2C2ENTWEDER4 oder auch na2(GURREN)2. . Dann ein2C2ENTWEDER4 Es ist ein kristalliner weißer Feststoff und seine wässrigen Lösungen sind grundlegend (alkalisch).
Natriumoxalat ist in Pflanzen und Gemüse vorhanden. Im menschlichen Wesen wird es auf natürliche Weise aus seiner konjugierten Säure -Oxalsäure erzeugt, was wiederum durch bestimmte Stoffwechselprozesse erzeugt wird.
 Natriumoxalat Na2(GURREN)2 solide. Lem [CC BY-SA 4.0 (https: // creativecommons.Org/lizenzen/by-sa/4.0)]]. Quelle: Wikimedia Commons.
Natriumoxalat Na2(GURREN)2 solide. Lem [CC BY-SA 4.0 (https: // creativecommons.Org/lizenzen/by-sa/4.0)]]. Quelle: Wikimedia Commons. Dann ein2C2ENTWEDER4 Es wird in chemischen Analyselabors als Reduktionsmittel verwendet (das Gegenteil von Oxidationsmittel). Auch um bestimmte organische Verbindungen während der Abwasserbehandlung Tests zu ermöglichen.
Es wurde zur Beseitigung von Chlorfluorkohlenwasserstoffen (CGC) verwendet, was die Ozonschicht schädigt. Es ist auch Rohmaterial, um auf wirtschaftliche Weise Oxalsäure zu erhalten.
Aufgrund des hohen Natriumoxalatgehalts einiger essbarer Gemüse sollten Menschen, die Tendenz haben, Berechnungen oder Nierensteine zu bilden, vermeiden, solche Lebensmittel zu konsumieren. Dies liegt daran, dass die Steine im Allgemeinen mit Oxalaten gebildet werden.
[TOC]
Struktur
Natriumoxalat besteht aus zwei Natriumna -Kationen+ und ein Oxalatanion (COO)22-. Oxalatanion wird wiederum von zwei COO gebildet- -Ooc-Coo-.
In festem Natriumoxalat hat Oxalatanion eine flache Form. .
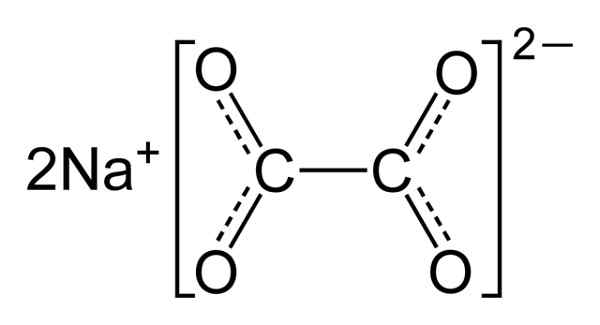 Chemische Struktur von Natriumoxalat2(GURREN)2. Autor: Benjah-BMM27. Quelle: Wikimedia Commons.
Chemische Struktur von Natriumoxalat2(GURREN)2. Autor: Benjah-BMM27. Quelle: Wikimedia Commons. Nomenklatur
- Natriumoxalat
- Dysodio Oxalat
- Natriumsalz von Etanodiosäure
Eigenschaften
Körperlicher Status
Kristalliner weißer Feststoff.
Molekulargewicht
134,0 g/mol
Dichte
2,27 g/cm3 bei 20 ° C.
Löslichkeit
Wasserlöslich: 3,7 g/100 ml bei 20 ° C.
pH
Seine wässrigen Lösungen sind grundlegend (alkalisch), weil das Oxalatanion Wasserprotonen nimmt, die die Ionen frei lassen-.
Kann Ihnen dienen: Neon: Geschichte, Eigenschaften, Struktur, Risiken, verwendetChemische Eigenschaften
Es kann Säuren neutralisieren und Reaktionen sind exotherm, dh sie geben Wärme ab.
Es dient als Reduktionsmittel und erzeugt bei diesen Reaktionen Kohlendioxid Co2.
Es hat die Eigenschaft, sich mehreren Metallionen wie Eisen -Eisenionen Glauben anzutreten2+ und Eisen Glauben3+.
Erhalten
Nach einer Konsultation einer Quelle kann Natriumoxalat oxidierende Sauerstoff erhalten werden oder2 bei einer Temperatur von etwa 250 ° C in einer konzentrierten Lösung von NaOH -Natriumhydroxid.
Präsenz in der Natur
Natriumoxalat ist in vielen Pflanzen und Gemüse wie Mahl, Spinat und Ruibarbo sowie in Körnern wie Sojabohnen vorhanden.
 Spinat hat viel Natriumoxalat. Autor: Aline Ponce. Quelle: Pixabay.
Spinat hat viel Natriumoxalat. Autor: Aline Ponce. Quelle: Pixabay. Seine konjugierte Säureoxalsäure tritt im menschlichen Organismus durch den Metabolismus von Glykolsäure oder Ascorbinsäure auf. Sobald es produziert wurde, wird es nicht metabolisiert, sondern durch oxalat -verdrückten Urin ausgeschieden.
 Ruibarbo enthält Natriumoxalat. Autoren: s. Hermann & F. Richter. Quelle: Pixabay.
Ruibarbo enthält Natriumoxalat. Autoren: s. Hermann & F. Richter. Quelle: Pixabay. Anwendungen
In Chemical Analysis Laboratories
Es wird als chemisches Reagenz verwendet, normalerweise als Reduktionsmittel, beispielsweise für die Standardisierung von Kaliumpermanganatlösungen, dh genau festzustellen, wie viel Natriumpermanganat sie haben.
In der Zerstörung von Chlorfluorkohlenwasserstoffen
Natriumoxalat wurde zur Zerstörung von Chlorfluorkohlenwasserstoffen (CFC) verwendet. Diese CFC -Verbindungen waren eine derjenigen, die für die Zerstörung der Ozonschicht des Planeten verantwortlich sind (was uns vor ultravioletten Strahlung schützt).
1996 schlugen einige Forscher die Verwendung von Natriumoxalat vor, um sie zu beseitigen, da sie leicht mit CFC bei Temperaturen von 270-290 ° C reagieren, wodurch sie harmlose Produkte in Richtung Ozonschicht machen.
Natriumoxalatreaktion mit CFCs kann kontrolliert werden, um halogenierte aromatische Kohlenwasserstoffe zu erhalten, die für die Ozonschicht nicht schädlich sind, sondern nützliche Verbindungen in der chemischen Industrie sind.
Es kann Ihnen dienen: Propylenglykol: Struktur, Eigenschaften, Synthese und VerwendungDiese Reaktion kann auch zum Maximum gebracht werden und den gesamten FCKW in NAF -Natriumfluorid, Soll -Natriumchlorid, elementarer Kohlenstoff und Kohlendioxid CO umwandeln2.
 Die Ozonschicht des Planeten schützt uns vor den ultravioletten Sonnenstrahlen. Natriumoxalat ermöglicht es Ihnen, die CFC -Verbindungen zu beseitigen, die es beschädigen. Autor: One94. Quelle: Pixabay.
Die Ozonschicht des Planeten schützt uns vor den ultravioletten Sonnenstrahlen. Natriumoxalat ermöglicht es Ihnen, die CFC -Verbindungen zu beseitigen, die es beschädigen. Autor: One94. Quelle: Pixabay. Bei der Bestimmung wichtiger Parameter bei der Abwasserbehandlung
Es wurde festgestellt, dass Natriumoxalat zur Messung der Menge und Klassen organischer Verbindungen, die die Schlammmikroorganismen zur Behandlung von Abwasser verwendet haben, nützlich ist.
Das Maß für solche Verbindungen ist wichtig, um ihre Funktion während der Behandlung von Abwasser zu bestimmen, da die Leichtigkeit der Trennung des Schlamms vom Wasser von ihnen abhängt.
Mit Natriumoxalat werden die Unannehmlichkeiten anderer Methoden vermieden.
Oxalsäure erhalten
Rohes Natriumoxalat aus Abfällen aus bestimmten Prozessen wurde verwendet, um Oxalsäure H zu produzieren H2C2ENTWEDER4 in großen Mengen.
Die Methode verwendet Schlamm aus dem Bayer -Prozess zur Behandlung von Bauxit (ein Aluminiummineral). Im Bayer -Prozess wird Bauxit mit NaOH -Natriumhydroxid behandelt, um die Aluminiumoxid dieses Minerals aufzulösen.
Beim Auflösen von Aluminiumoxid werden bestimmte organische Verbindungen im Mineral wie Huminsäuren von NaOH angegriffen, wodurch eine große Menge Natriumoxalat na erzeugt wird2C2ENTWEDER4.
Dieses Natriumoxalat ist in einen Schlamm mit Aluminiumverbindungen eingebaut. Um es zu reinigen, wird die Baugruppe aufgelöst, sie wird gefiltert und durch eine Säule des ionischen Ionenstörungssäule vom Typ ".
In der Säule gibt es ein RSO -Sulfonsäureharz3H wo na metallische Ionen ausgetauscht werden+ durch Wasserstoffionen h+, Sie bekommen also Oxalsäure h2C2ENTWEDER4.
Rso3H + Na2C2ENTWEDER4 ⇔ rso3Na + Nahc2ENTWEDER4
Kann Ihnen dienen: Kaliumcarbonat (K2CO3): Struktur, Eigenschaften, Verwendungen, erhaltenRso3H + Nahc2ENTWEDER4 ⇔ rso3Na + h2C2ENTWEDER4
Dies ist ein wirtschaftlicher Prozess und die erhaltene Oxalsäure ist von akzeptabler Reinheit.
Unerwünschte Verbindungen entfernen
Konjugierte Natriumoxalatsäure, Oxalsäure H2C2ENTWEDER4, Es wird verwendet, um bestimmte Arten von Abfall und Inlays aufzulösen.
Die Oxalsäure, die für Oxalat charakteristisch ist.
Oxalsäure wird auch verwendet, um die Inlays von Mineralien und Eisenoxiden in Rohren und anderen Geräten zu entfernen. Dies liegt an der Fähigkeit, sich dem Eisen Ionen -Ionenvertrauen stark anzuschließen2+ als der Eisen -Ionen -Glaube3+ Oxalate bilden.
Risiken
Wenn Natriumoxalat direkt eingeatmet oder aufgenommen wird. Es erzeugt Erbrechen, schwere Spülung, schwacher Puls, kardiovaskulärer Kollaps, neuromuskuläre Symptome und Nierenschäden.
Menschen, die die Tendenz haben, Berechnungen in den Nieren zu bilden, da Oxalat im Urin ansammelt.
Natriumoxalat in hohen Mengen an Lebensmitteln beim Erreichen von Urin bindet an das in diesem Bereich vorhandene Kalzium und kann Berechnungen oder Steine von Calciumoxalat in den Nieren für Menschen herstellen, die dazu neigen, dies zu tun.
 Natriumoxalat einiger Lebensmittel kann zur Bildung von Steinen in den Nieren von Menschen mit Veranlagung führen. Autor: Azwer. Quelle: Pixabay.
Natriumoxalat einiger Lebensmittel kann zur Bildung von Steinen in den Nieren von Menschen mit Veranlagung führen. Autor: Azwer. Quelle: Pixabay. Verweise
- ODER.S. Nationalbibliothek für Medizin. (2019). Natriumoxalat. Nationales Zentrum für Biotechnologie Information. Aus Pubchem geborgen.NCBI.NLM.NIH.Regierung.
- Chai, w. Und Liebman, m. (2005). Auswirkung verschiedener Kochmethoden auf den Gehalt von Gemüseoxalat. J. Landwirtschaftlich. Food Chem. 2005, 53, 3027-3030. Aus Pubs geborgen.ACS.Org.
- Dagani, r. (neunzehn sechsundneunzig). CFC zerstören die Reisung. Archiv Chemical & Engineering News 1996, 74, 4, 6-7. Aus Pubs geborgen.ACS.Org.
- Sajad, m. und Kim, k.S. (2016). Extraktion extrazellulärer polymerer Substanzen aus aktiviertem Schlamm unter Verwendung von Natriumoxalat. Int. J. Umfeld. Sci. Technol. 13, 1697-1706 (2016). Link wiederhergestellt.Springer.com.
- Jeffrey, g.ZU. Und Parry, G.S. (1954). Die Kristallstruktur von Natriumoxalat. J. BIN. Chem. SOC. 1954, 76, 21, 5283-5286. Aus Pubs geborgen.ACS.Org.
- Okuwaki, a. et al. (1984). Produktion von Oxalat durch Oxidation von Kohle mit Sauerstoff in einer konzentrierten Natriumhydroxidlösung. Ind. Eng. Chem. Prod. Rindfleisch. Dev. 1984, 23, 648-651. Aus Pubs geborgen.ACS.Org.
- Hefter, g. et al. (2018). Löslichkeit von Natriumoxalat in konzentrierten Elektrolytlösungen. J Chem & Eng Daten. 2018, 63, 3, 542-552. Aus Pubs geborgen.ACS.Org.
- La k. Yo. (1992). Prozess zur Herstellung von Oxalsäure und Natriumwasserstoffoxalat aus Rohstoffoxalat. ODER.S. Patent Nr. 5,171.887. Dez.15, 1992. Aus Freepatentssonline abgerufen.com.
- « HAPTES GESCHICHTE, FUNKTIONEN, MÄDCHER, INMUNES ANTWORTEN
- Natriumtripoliphosphat (Na5p3O10) Struktur, Eigenschaften, Verwendungszwecke, Auswirkungen »

