Oxácido

- 3968
- 722
- Ibrahim Steuk
 Pertektalisches Säuremolekül, eine sehr seltene OXO -Säure aus Tecnecio. Quelle: Jynto, Wikimedia Commons
Pertektalisches Säuremolekül, eine sehr seltene OXO -Säure aus Tecnecio. Quelle: Jynto, Wikimedia Commons Was ist eine Oxazid?
A Oxácido, U oxoacid, es ist eine Säure, die Sauerstoff enthält. Es besteht aus Wasserstoff, Sauerstoff und einem nicht -metallischen Element, das das sogenannte zentrale Atom ausmacht. Abhängig von der Anzahl der Sauerstoffatome, und daher kann die Oxidationszustände des nicht -metallischen Elements mehrere Oxaziden bilden.
Oxcaziden haben eine große Anzahl von Verwendungen, die im Allgemeinen schwer zu beschreiben sind. Die Anwendung hängt stark vom zentralen Atom und der Anzahl der Sauerstoff ab.
Sie können von Verbindungen zur Synthese von Materialien, Düngemitteln und Sprengstoff dienen, selbst für analytische Zwecke oder die Herstellung von Erfrischungsgetränken, wie es bei Kohlensäure und Phosphorsäure auftritt, h3Po4, Teil der Komposition dieser Getränke sein.
Eigenschaften und Eigenschaften von Oxcaziden
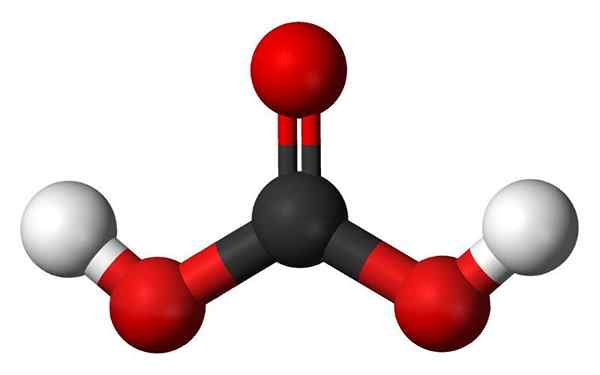 Kohlensäuremolekül. Quelle: Jynto und Ben Mills, Wikimedia Commons
Kohlensäuremolekül. Quelle: Jynto und Ben Mills, Wikimedia Commons - Hydroxylgruppen: Eines der Hauptmerkmale eines Oxácido ist nicht nur, dass es Sauerstoff hat, sondern auch wie eine OH -Gruppe. Andererseits haben einige Oxaziden eine sogenannte OXO -Gruppe, e = o. Im Fall von Phosphorsäure hat es eine OXO -Gruppe, p = o. Ihnen fehlen H -Atome, so dass sie für die Säure nicht verantwortlich sind.
- Zentralatom: Das zentrale Atom (e) kann je nach Ort im Block P der Periodenzüchter ein elektronegatives Element sein oder nicht. Andererseits zieht Sauerstoff, ein etwas elektronegativeres Element als Stickstoff, die Elektronen der OH+. E ist daher mit OH -Gruppen verbunden. Wenn ein Ion H freigelassen wird+ Säureionisation tritt auf, dh sie erhält eine elektrische Ladung, die in ihrem Fall negativ ist. Eine Oxcazid kann so viele H -Ionen freisetzen+ Wie OH -Gruppen in seiner Struktur und je mehr es gibt, desto größer wird die negative Belastung.
- Saure Kraft: Die Kraft fast aller Oxaziden mit dem gleichen zentralen Atom (kein Metall) und zunimmt mit dem Anstieg des Oxidationsstatus des zentralen Elements, was wiederum direkt mit der Zunahme der Anzahl von Sauerstoffatomen zusammenhängt.
Zum Beispiel werden drei Oxazidreihen gezeigt, deren Säure von den Säurehöern von den meisten bis zum größten geordnet ist:
H2SW3 < H2SW4
Hno2 < HNO3
HCLO < HClO2 < HClO3 < HClO4
In den meisten Oxaziden, die unterschiedliche Elemente mit dem gleichen Oxidationszustand haben, jedoch zu derselben Gruppe der Periodenzüchter angehören, nimmt die Säurekraft direkt mit der Elektronegativität des zentralen Atoms zu:
H2SEO3 < H2SW3
H3Po4 < HNO3
Hbro4 < HClO4
Oxcacid -Bildung
Wie zu Beginn erwähnt, werden Oxácidos erzeugt, wenn bestimmte Substanzen, als Säureoxide bezeichnet werden, mit Wasser reagieren. Dies wird anhand des gleichen Beispiels für Kohlensäure erklärt.
Co₂+h₂o h2CO3
Säureoxid + Wasser => Oxácido
Was passiert ist, dass das Molekül von H₂o kovalent mit dem von Co₂ bindet. Wenn Wasser durch Wärme beseitigt wird, wird das Gleichgewicht zur Regeneration der CO₂ -Bewegungen, dh ein heißes Soda -Getränk.
Andererseits werden Säuroxide gebildet, wenn ein nicht -metallisches Element mit Wasser reagiert, obwohl genauer+.
Es wurde bereits gesagt, dass die Ionen h+ Sie sind das Produkt der resultierenden Oxazidierenionisation.
Trainingsbeispiele
Das Chloroxid, CL2ENTWEDER5, Reagieren Sie mit Wasser, um die Chlorsäure zu geben:
Cl2ENTWEDER5 + H₂O => HCLO3
Schwefeloxid also3, Reagiert mit Wasser, um Schwefelsäure zu bilden:
SW3 + H₂o => h2SW4
Und das periódische Oxid, ich2ENTWEDER7, reagiert mit Wasser, um die Periódinsäure zu bilden:
Yo2ENTWEDER7 + H₂o => hio4
Zusätzlich zu diesen klassischen Mechanismen für die Oxazidenbildung gibt es andere Reaktionen für denselben Zweck.
Kann Ihnen dienen: Endotherme ReaktionZum Beispiel Phosphor -Trichlorid, PCL3, Es reagiert mit Wasser, um Phosphorsäure, Oxácido und Salzsäure, eine Halohydrische Säure.
PCL3 + 3H2O => h3Po3 + HCl
Und Phosphorpentachlorid, PCL5, reagiert mit Wasser, um Phosphorsäure und Salzsäure zu ergeben.
PCL5 + 4 h₂o => h3Po4 + HCl
Metalloxcaziden
Einige Übergangsmetalle bilden Säuroxide, dh sie lösen im Wasser auf, um Oxaziden zu ergeben.
Manganoxid (VII) (permanganisches Anhydrum) mn2ENTWEDER7 Und Chromoxid (VI) sind die häufigsten Beispiele.
Mn2ENTWEDER7 + H₂o => hmno4 (Permangansäure)
Cro3 + H₂o => h2Cro4 (Chromsäure)
Nomenklatur
Valencia -Berechnung
Einen Oxácid korrekt zu ernennen. Ausgehend von der generischen HEO -Formel wird Folgendes berücksichtigt:
- Das O hat Valencia -2.
- Die Valencia de los h es +1.
In diesem Sinne das Oxácid. Daher haben Sie die folgende algebraische Summe:
-2 + 1 + e = 0
E = 1
Daher ist E +1 Valencia.
Dann die möglichen Valenzen, die haben können und. Wenn unter ihren Valences Werte +1, +3 und +4 sind und dann mit seinem kleinen Valencia "arbeiten".
Nennen Sie Säure
HEO zu ernennen, beginnt es mit dem Namen Säure, gefolgt von dem Namen E mit den Suffixe -ICO, wenn Sie mit dem größten Valencia oder -auf. Wenn es drei oder mehr gibt, werden die Hypo-Präfixe verwendet, um sich auf das Minderjährige und die größeren Valenzen zu beziehen.
So würde Heo genannt:
Säure Schluckauf(Name von e)tragen
Da +1 der geringste seiner drei Valences ist. Und wenn es heo wäre2, Dann hätte ich Valencia +3 und es würde genannt:
Es kann Ihnen dienen: DiphenylaminSäure (e)tragen
Und auf die gleiche Weise für Heo3, Mit E arbeiten mit Valencia +5:
Säure (e)ICO
Beispiele
- Cromensäure (h)2Cr2ENTWEDER4). Es ist eine starke, instabile Säure bei hohen Temperaturen.
- Dicromensäure (h)2Cr2ENTWEDER7). Sein Vorhandensein ist in Chromsäurgemischungen zu spüren, die zum Reinigen des Glas verwendet werden.
- Hypochlorsäure (HCLO). Schnell Hautgewebe reparieren.
- Bromous Säure (Hbro2). Es ist eine mittlere, instabile Verbindung. Bromo -Verbindung.
- Orthophosphorsäure (h)3Po4). Reizungssäure für nicht Kraftstoffhaut.
- Permangansäure (HMNO4). Sehr starke Säure.
- Periódinsäure (HIO4). In der organischen Chemie wird es verwendet, um die Strukturen anderer Moleküle zu analysieren.
- Bromsäure (Hbro3). Oxcazid von Brom. Seine Salze oxidieren stark.
- Hypobromen Säure (Hbro). Es wird in verdünnte wässrige Lösung verwendet und durch Reaktion zwischen Wasser und BR erhalten2.
- Metaphosphorsäure (HPO3). Sehr ätzend, farblos und Toilette fest bei Raumtemperatur fest.
- Yodiumsäure (HIO3). Reaktiv zum Nachweis von Morphin in einem Produkt.
- Schwefelsäure (h2SW3). Sauren Regen verursachen.
- Schwefelsäure (h2SW4). Regelmäßig für Metallverarbeitung und Düngemittel ist es eine der am häufigsten verwendeten chemischen Verbindungen.
- Salpetersäure (HNO3). Laborreagenz, sehr gefährlich, weil es die Haut verbrennen kann.
- Chlorsäure (HCLO3). Beim Zersetzen produziert es viele Produkte. Es ist kalt stabil auf eine Konzentration von 30%.
- Arseniosäure (h3ASO3). Enthält Arsen und ist sehr giftig und krebserregend. Es wird in Herbiziden und Pestiziden verwendet.
- Ortosilmisäure (h)4Siio4). Schwache Säure, die als Stütz- oder Trockenmittelmittel verwendet wird.
- Kohlensäure (h)2CO3). Es wird verwendet, um Erfrischungsgetränke zu machen.
- Lessrosensäure (HNO2). In Lösung ist es bemerkenswert dissoziiert.
- Metaborsäure (HBO2). Leicht löslich kristalliner weißer Feststoff fest.
Verweise
- Gemeinsame Oxoacid -Verbindungen. Von Thakedco erholt.com.

