Molekulare Sauerstoffstruktur, Eigenschaften, verwendet
- 1841
- 275
- Frederike Birkemeyer
Er Molekularer Sauerstoff entweder Dioxygen, Auch als Diatom oder gasförmiger Sauerstoff bezeichnet, ist es die häufigste Elementarform, in der dieses Element auf Planeten Erde gefunden wird. Seine Formel ist oder2, Daher ein Diatom- und homonukleärer Molekül, völlig apolar.
Die Luft, die wir atmen, besteht aus etwa 21% Sauerstoff als Moleküle oder2. Je mehr wir aufsteigen3. Unser Körper nutzt das o2 Um Ihr Gewebe zu sauerstoffhaltigen und zelluläre Atmung durchführen.
 Ohne Sauerstoff zu bereichern, wäre das Leben in unserem Atmosphäre ein nicht nachhaltiges Phänomen. Quelle: Pixabay.
Ohne Sauerstoff zu bereichern, wäre das Leben in unserem Atmosphäre ein nicht nachhaltiges Phänomen. Quelle: Pixabay. Das Ö2 Er ist auch für die Existenz des Feuers verantwortlich: Ohne ihn wäre es fast unmöglich, Brände und Verbrennungen zu führen. Dies liegt daran2-.
Molekulares Sauerstoff ist für unzählige aerobe Prozesse von wesentlicher Bedeutung, die Anwendungen in Metallurgie, Medizin und Abwasserbehandlung haben. Dieses Gas ist praktisch gleichbedeutend mit Hitze, Atmung, Oxidation und andererseits von gefrorenen Temperaturen, wenn es in seinem flüssigen Zustand ist.
[TOC]
Molekulare Sauerstoffstruktur
 Gasförmige Sauerstoffmolekularstruktur. Quelle: Benjah-BMM27 über Wikipedia.
Gasförmige Sauerstoffmolekularstruktur. Quelle: Benjah-BMM27 über Wikipedia. Im oberen Bild haben wir die molekulare Struktur des gasförmigen Sauerstoffs mit mehreren Modellen. In den letzten beiden werden die Eigenschaften der kovalenten Bindung, die die Sauerstoffatome halten.
Kann Ihnen dienen: DiagrammeDas Molekül oder2 Es ist linear, homonukleär und symmetrisch. Die Doppelbindung hat eine Länge von 121 Uhr. Diese kurze Entfernung macht eine bestimmte beträchtliche Energie erforderlich (498 kJ/mol), um die Verbindung o = o zu brechen, und ist daher ein relativ stabiles Molekül.
Wenn ja, hätte sich der Sauerstoff der Atmosphäre im Laufe der Zeit vollständig verschlechtert, oder die Luft würde auf nichts Feuer fangen.
Eigenschaften
Aussehen
Molekularer Sauerstoff ist farbloses, geschmacklos und geruchloses Gas, aber beim Kondenseln und Kristalls erregt bläuliche Töne.
Molmasse
32 g/mol (abgerundeter Wert)
Schmelzpunkt
-218 ºC
Siedepunkt
-183
Löslichkeit
Molekular Sauerstoff ist in Wasser nicht sehr löslich, aber genug, um die Meeresfauna zu unterstützen. Wenn Ihre Löslichkeit größer wäre, wäre es weniger wahrscheinlich, dass sie an Ertrinken sterben würde. Andererseits ist seine Löslichkeit bei Ölen und apolaren Flüssigkeiten viel größer, da sie sie langsam oxidieren und so ihre ursprünglichen Eigenschaften beeinflussen können.
Energiezustände
Molekular Sauerstoff ist eine Substanz, die von der Valencia Link Theory (TEV) nicht vollständig beschrieben werden kann.
Die elektronische Sauerstoffkonfiguration lautet wie folgt:
[Er] 2S² 2p⁴
Es hat ein Paar fehlender Elektronen (oder :). Wenn zwei Sauerstoffatome gefunden werden, sind sie mit einer Doppelbindung O = O verbunden, wobei beide Oktett von Valencia abgeschlossen sind.
Daher das Molekül oder2 Es sollte diamagnetisch sein, mit all seinen gepaarten Elektronen. Es handelt sich jedoch um ein paramagnetisches Molekül, und dies wird durch das Diagramm seiner molekularen Orbitale erklärt:
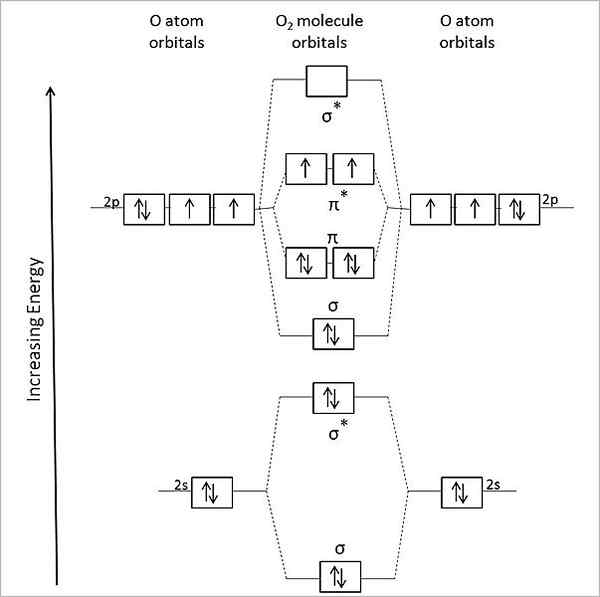 Molekulares Orbitaldiagramm für Gassauerstoff. Quelle: Anthony.Sebastian/CC BY-SA (https: // CreePecommons.Org/lizenzen/by-sa/3.0)
Molekulares Orbitaldiagramm für Gassauerstoff. Quelle: Anthony.Sebastian/CC BY-SA (https: // CreePecommons.Org/lizenzen/by-sa/3.0) Somit beschreibt die molekulare Orbitalentheorie (Tom) das oder besser2. Die beiden fehlenden Elektronen befinden sich in den molekularen Orbitalen π*, von größerer Energie und mit ihrem paramagnetischen Charakter Sauerstoff geben.
Kann Ihnen dienen: Methylamin: Struktur, Eigenschaften, Produktion, verwendetTatsächlich entspricht dieser Energiezustand Triplettsauerstoff, 3ENTWEDER2, Der vorherrschendste von allen. Der andere Energiezustand des Sauerstoffs, weniger häufig auf der Erde, ist die Single, 1ENTWEDER2.
Transformationen
Molekularer Sauerstoff ist beträchtlich stabil, solange er nicht mit einer Substanz in Kontakt steht, die anfällig für Oxidation ist, geschweige denn, wenn es keine enge Quelle intensiver Wärme gibt, wie ein Funken. Das liegt daran, dass o2 Es hat eine hohe Tendenz, Elektronen aus anderen Atomen oder Molekülen zu reduzieren, Elektronen zu gewinnen.
Wenn reduziert wird, ist es in der Lage, ein breites Spektrum von Links und Formen festzulegen. Wenn es kovalente Bindungen bildet, wird es dies mit weniger elektronegativen Atomen als er tun, einschließlich Wasserstoff, um Wasser zu studieren, H-o-H. Es kann auch das Kohlenstoffuniversum sein, um C-O-Bindungen und verschiedene Arten von sauerstoffhaltigen organischen Molekülen (Éteres, Ketone, Aldehyde usw.) zu verursachen.).
Das Ö2 Sie können auch Elektronen gewinnen, um sich in Peroxiden und Superoxiden zu transformieren, oder22- ICH2-, bzw. Wenn es im Organismus Peroxid wird, wird Wasserstoffperoxid erhalten, h2ENTWEDER2, H-O-O-H, eine schädliche Verbindung, die durch die Wirkung bestimmter Enzyme (Peroxidasen und Katalas) verarbeitet wird.
Andererseits und nicht zuletzt das o2 reagiert mit anorganischer Materie, um Oxidanion zu werden, oder2-, Komponieren einer endlosen Liste von mineralogischen Massen, die die Rinde und den Landmantel anschwellen und Landmantel.
Anwendungen
Schweißnähte und Verbrennung
 Sauerstoff wird verwendet. Quelle: Sheila/CC von (https: // creativeCommons.Org/lizenzen/by/2.0)
Sauerstoff wird verwendet. Quelle: Sheila/CC von (https: // creativeCommons.Org/lizenzen/by/2.0) Sauerstoff wird verwendet, um die Verbrennungsreaktion durchzuführen, durch die eine Substanz exotherm von Feuer gibt. Dieses Feuer und seine Temperatur variieren je nach Verbrennung der Substanz. Somit können sehr heiße Flammen erhalten werden, wie Acetylen (oben), mit denen Metalle und Legierungen verschweißt werden.
Kann Ihnen dienen: EnthalpieWenn nicht für Sauerstoff, konnten die Kraftstoffe nicht verbrennen und ihre gesamte Kalorienergie liefern, zum Abheben von Raketen oder zum Starten von Autos verwendet.
Oxidationsmittel in der grünen Chemie
Dank dieses Gases werden endlose organische und anorganische Oxide synthetisiert oder industriell hergestellt. Diese Reaktionen basieren auf der oxidierenden Kraft des molekularen Sauerstoffs, der auch zu den lebensfähigsten Reagenzien der grünen Chemie für die Erlangung von Pharmazeutikalprodukten ist.
Unterstützung bei assistierter Atmung und Abwasserbehandlung
Sauerstoff ist von entscheidender Bedeutung, um die Nachfrage der Atemweg bei Patienten mit schwerwiegenden Gesundheitszuständen, bei Tauchern, wenn sie in niedrigen Tiefen und in Bergkletterern absteigen, und in deren Höhen die Sauerstoffkonzentration dramatisch reduziert aussieht.
Ebenso "füttert" der Sauerstoff aerobe Bakterien, die dazu beitragen.
Verweise
- Shiver & Atkins. (2008). Anorganische Chemie. (vierte Edition). Mc Graw Hill.
- Wikipedia. (2020). Sauerstoffallotrope. Abgerufen von: in.Wikipedia.Org
- Hone, c.ZU., Kappe, c.ENTWEDER. (2019). Die Verwendung von molekularem Sauerstoff für flüssige Phase aerobe Oxidationen im kontinuierlichen Fluss. Top Curr Chem (z)377, 2. doi.org/10.1007/S41061-018-0226-Z
- Kevin Beck. (28. Januar 2020). 10 Verwendungen für Sauerstoff. Erholt von: Scienting.com
- Cliffsnotes. (2020). Biochemie I: Die Chemie des molekularen Sauerstoffs. Erholt von: Cliffsnotes.com
- GZ Industrial Supplies. (2020). Industrielle Vorteile von Sauerstoffgas. Abgerufen von: GZ-Supplies.com
- « Kultur der portugiesischen Traditionen, Bräuche, Gastronomie, Religion
- Zerstörerische Interferenzformel und Gleichungen, Beispiele, Übung »

