Sauerstoffeigenschaften, Struktur, Risiken, verwendet

- 811
- 37
- Ivan Pressler
Er Sauerstoff Es ist ein chemisches Element, das durch das Symbol oder durch das Symbol dargestellt wird. Es ist ein sehr reaktiv. Dieser Name liegt daran, dass Schwefel und Sauerstoff in fast allen Mineralien vorhanden sind.
Seine hohe Elektronegativität erklärt seine große Avidität durch Elektronen, was dazu führt, dass sie mit einer hohen Anzahl von Elementen kombiniert. So entsteht eine Vielzahl von Mineraloxiden, die die Erdkruste bereichern. So komponiert der verbleibende Sauerstoff und macht die Atmosphäre atmungsaktiv.
 Sauerstoff ist normalerweise gleichbedeutend mit Luft und Wasser, ist aber auch in Felsen und Mineralien vorhanden. Quelle: pxhere.
Sauerstoff ist normalerweise gleichbedeutend mit Luft und Wasser, ist aber auch in Felsen und Mineralien vorhanden. Quelle: pxhere. Sauerstoff ist das dritte Element im Überfluss im Universum hinter Wasserstoff und Helium und ist auch der Hauptmassenbestandteil der Erdekortex. Es hat einen Volumenanteil von 20,8% der Erdatmosphäre und entspricht 89% der Wassermasse.
Es hat normalerweise zwei allotropische Formen: Diatomsauerstoff (oder2), was der häufigste Weg in der Natur und Ozon ist (oder3), gefunden in der Stratosphäre. Es gibt jedoch zwei andere (oder4 ICH8) das existieren in seinen flüssigen oder festen Phasen und unter enormen Druck.
Sauerstoff wird ständig durch den Photosyntheseprozess erzeugt, der von Phytoplankton und terrestrischen Pflanzen durchgeführt wird. Einmal produziert, wird es freigesetzt, damit Lebewesen es verwenden können, während sich ein kleiner Teil davon in den Meeren löst und das Wasserleben unterstützt.
Es ist daher ein wesentliches Element für Lebewesen; Nicht nur, weil es in den meisten Verbindungen und Molekülen vorhanden ist, die sie bilden, sondern auch in all ihren Stoffwechselprozessen eingreifen.
Obwohl seine Isolation Carl Scheele und Joseph Priestley im Jahr 1774 umstritten ist, gibt es Anzeichen dafür, dass Sauerstoff tatsächlich erstmals von Michael Sendivogius isoliert wurde.
Dieses Gas wird in der medizinischen Praxis verwendet, um die Lebensbedingungen von Patienten mit Atemschwierigkeiten zu verbessern. Ebenso wird Sauerstoff verwendet, um den Menschen die Erfüllung ihrer Funktionen in Umgebungen zu ermöglichen, in denen es abnimmt oder keinen Zugang zu atmosphärischen Sauerstoffgassen.
Kommerziell produzierter Sauerstoff wird hauptsächlich in der metallurgischen Industrie zur Eisenumwandlung in Stahl eingesetzt.
[TOC]
Geschichte
Nitroarialgeist
Im Jahr 1500, Leonardo da Vinci, basierend auf den Experimenten von Philo de Byzanz im zweiten Jahrhundert an. C., Er kam zu dem Schluss, dass während der Verbrennung und Atmung ein Teil der Luft verzehrt wurde.
1608 zeigte Cornelius Drebble diesen Heizungsraum (Silbernitrat, Kno3) Ein Gas trat auf. Dieses Gas war, wie es später bekannt wäre, Sauerstoff; Aber Drebble konnte es nicht als neues Element identifizieren.
Dann, 1668, wies John Majow darauf hin, dass ein Teil der Luft, den er "Spiritus nitroaerus" nannte. Majow beobachtete, dass Substanzen in Abwesenheit des Nitroarialgeistes nicht arrangierten.
Majoow führte die Antimonverbrennung durch und beobachtete eine Zunahme des Gewichts des Antimon während seiner Verbrennung. Dann kam Majow zu dem Schluss, dass das Antimon in Kombination mit dem Nitroarialgeist.
Entdeckung
Obwohl er keine Anerkennung von der wissenschaftlichen Gemeinschaft, im Leben oder nach seinem Tod erhielt, ist Michael Sandivogius (1604) wahrscheinlich der wahre Entdecker des Sauerstoffs.
Sandivogius war Alchemist, Philosoph und schwedischer Arzt, der die thermische Zersetzung von Kaliumnitrat herstellte. Seine Experimente führten ihn zur Freisetzung von Sauerstoff, die er "Cibus Vitae" nannte: Lebensmittel des Lebens.
Zwischen 1771 und 1772 erwärmte der schwedische Chemiker Carl W Scheele mehrere Verbindungen: Kaliumnitrat, Manganoxid und Quecksilberoxid. Scheele beobachtete, dass ein Gas, das die Verbrennung erhöhte, von ihnen freigesetzt wurde und zu dem er "Feuerluft" bezeichnete, und zu dem er "Feuerluft" nannte.
Joseph Priestly Experimente
Im Jahr 1774 warm der englische Chemiker Joseph Priestly erwärmte Quecksilberoxid unter Verwendung einer zwölf -Zoll -Zunahme, die das Sonnenlicht konzentrierte. Quecksilberoxid setzte ein Gas frei, das die Kerze viel schneller verbrannte als normal.
Darüber hinaus testete Priester die biologische Wirkung von Gas. Dazu legte er eine Maus in einen geschlossenen Behälter, von dem er erwartet hatte, dass er fünfzehn Minuten überleben würde; In Gegenwart von Gas überlebte er jedoch eine Stunde, mehr als er schätzte.
Priestly veröffentlichte seine Ergebnisse 1774; Während Scheele es 1775 tat. Aus diesem Grund wird die Entdeckung von Sauerstoff zum Priesterly normalerweise zugeschrieben.
Sauerstoff in der Luft
Antoine Lavosier, ein französischer Chemiker (1777), entdeckte, dass die Luft 20% Sauerstoff enthält und dass sie beim Verbrennen einer Substanz tatsächlich mit Sauerstoff kombiniert wird.
Lavoisier kam zu dem Schluss, dass die offensichtliche Gewichtszunahme, die Substanzen während der Verbrennung erlebten, auf den Gewichtsverlust zurückzuführen war, der in der Luft auftritt; Da Sauerstoff kombiniert mit diesen Substanzen und daher die Massen der Reaktanten erhalten wurden.
Dies ermöglichte es Lavosier, das Gesetz der Erhaltung der Materie festzulegen. Lavoizier schlug den Namen des Sauerstoffs vor. Dann bedeutet Sauerstoff "Säure früher".
Dieser Name ist falsch, da nicht alle Säuren Sauerstoff enthalten; Zum Beispiel Wasserstoffhalogenide (HF, HCl, HBR und HI).
Dalton (1810) dem Wasser die chemische Formel HO und damit das Atomgewicht des Sauerstoffs 8 betrug 8. Eine Gruppe von Chemikalien, darunter: Davy (1812) und Berzelius (1814) korrigierten Daltons Ansatz und kam zu dem Schluss, dass die richtige Formel des Wassers h ist2O und das Atomgewicht des Sauerstoffs beträgt 16.
Kann Ihnen dienen: disionisiertes WasserPhysikalische und chemische Eigenschaften
Aussehen
Farblos, Toilette und geschmackloses Gas; Während Ozone einen Morgen riecht. Sauerstoff bevorzugt die Verbrennung, aber an sich ist es kein Kraftstoff.
 Flüssiger Sauerstoff. Quelle: Staff Sgt. Nika Glover, u.S. Luftwaffe [Public Domain]
Flüssiger Sauerstoff. Quelle: Staff Sgt. Nika Glover, u.S. Luftwaffe [Public Domain] In seiner flüssigen Form (oberes Bild) ist es hellblau und seine Kristalle sind ebenfalls bläulich; Aber sie können rosa, orange und sogar rötliche Töne erwerben (wie im Abschnitt ihrer Struktur erklärt wird).
Atomares Gewicht
15.999 u.
Atomnummer (z)
8.
Schmelzpunkt
-218.79 ºC.
Siedepunkt
-182,962 ºC.
Dichte
Unter normalen Bedingungen: 1.429 g/l. Sauerstoff ist ein dichtestes Gas als Luft. Darüber hinaus ist es ein schlechter Leiter von Wärme und Strom. Und an seinem Siedepunkt (Flüssigkeit) beträgt die Dichte 1.141 g/ml.
Dreifacher Punkt
54.361 K und 0,1463 kPa (14,44 atm).
Kritischer Punkt
154.581 K und 5.043 MPa (49770,54 atm).
Fusionshitze
0,444 kJ/mol.
Verdampfungswärme
6,82 kJ/mol.
Molkalorienkapazität
29.378 J/(mol · k).
Dampfdruck
Bei einer Temperatur von 90 K hat einen Dampfdruck von 986,92 atm.
Oxidationszustände
-2, -1, +1, +2. Der wichtigste Oxidationsstatus beträgt -2 (oder2-).
Elektronegativität
3.44 auf der Paulingskala
Ionisationsenergie
Erstens: 1.313.9 kJ/mol.
Zweitens: 3.388.3 kJ/mol.
Dritte: 5.300,5 kJ/mol.
Magnetische Ordnung
Paramagnetisch.
Wasserlöslichkeit
Die Sauerstofflöslichkeit im Wasser nimmt mit zunehmender Temperatur ab. Zum Beispiel: 14,6 ml Sauerstoff/l Wasser werden bei 0 ºC und 7,6 ml Sauerstoff/l Wasser bei 20 ºC gelöst. Die Löslichkeit von Sauerstoff in Trinkwasser ist größer als im Meerwasser.
Im Temperaturzustand von 25 ° C und bei einem Druck von 101,3 kPa kann das Trinkwasser 6,04 ml Sauerstoff/l Wasser enthalten. Während Meerwasserwasser nur 4,95 ml Sauerstoff/l Wasser.
Reaktivität
Sauerstoff ist ein hochreaktives Gas, das direkt mit fast allen Elementen bei Raumtemperatur und hohen Temperaturen reagiert. mit Ausnahme von Metallen mit höheren Reduktionspotentialen als Kupfer.
Sie können auch mit den Verbindungen reagieren und die darin enthaltenen Elemente oxidieren. Dies passiert, wenn es beispielsweise mit Glukose reagiert, um Wasser und Kohlendioxid zu erzeugen. oder wenn das Holz oder ein Kohlenwasserstoff brennt.
Sauerstoff kann Elektronen durch vollständige oder teilweise Übertragung akzeptieren. Daher wird er als Oxidationsmittel angesehen.
Die häufigste Oxidationszahl oder der Oxidationsstatus beträgt -2. Mit dieser Oxidationszahl findet es im Wasser (h2O), Schwefeldioxid (also2) und Kohlendioxid (co2).
Auch in organischen Verbindungen wie Aldehyde, Alkohole, Carbonsäuren; Gemeinsame Säuren wie h2SW4, H2CO3, Hno3; und in seinen abgeleiteten Salzen: na2SW4, N / A2CO3 OK Nein3. In allen von ihnen konnte die Existenz des O angenommen werden2- (was für organische Verbindungen nicht gilt).
Oxide
Sauerstoff ist als oder vorhanden2- In den kristallinen Strukturen von Metalloxiden.
Andererseits in Metall -Superoxiden wie Kalium -Superoxid (KO2), Sauerstoff ist wie Ion oder2-. Während in Metallperoxiden, um Bariumperoxid zu sagen (BAO2), Sauerstoff wird als Ion vorgestellt oder22- (Ba2+ENTWEDER22-).
Isotope
Sauerstoff hat drei stabile Isotope: 16Oder mit 99,76% Häufigkeit; Er 17Oder mit 0,04%; und das 18Oder mit 0,20%. Beachten Sie, dass er 16Oder es ist bei weitem das stabilste und reichlichste Isotop.
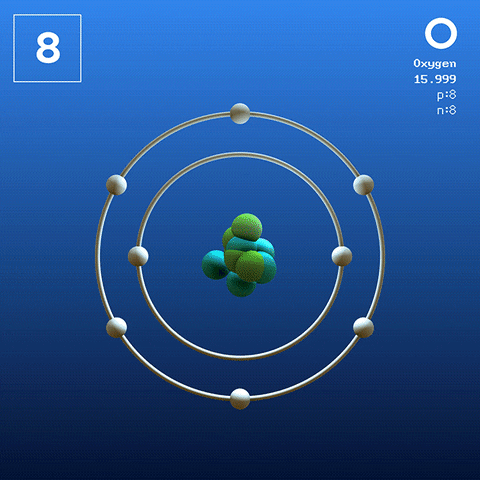
Elektronische Struktur und Konfiguration
Sauerstoffmolekül und Wechselwirkungen
 Diatom -Sauerstoffmolekül. Quelle: Claudio Pistilli [CC BY-SA 4.0 (https: // creativecommons.Org/lizenzen/by-sa/4.0)]]
Diatom -Sauerstoffmolekül. Quelle: Claudio Pistilli [CC BY-SA 4.0 (https: // creativecommons.Org/lizenzen/by-sa/4.0)]] Sauerstoff in seinem basalen Zustand ist ein Atom, dessen elektronische Konfiguration lautet:
[Er] 2s2 2 p4
Nach der Valencia Link Theory (TEV) werden zwei Sauerstoffatome kovalent miteinander verbunden, so dass beide ihren Oktett von Valencia separat abschließen. Neben der Fähigkeit, ihre beiden einsamen Elektronen der Orbitale zu paaren, 2p.
Auf diese Weise erscheint das Sauerstoff -Diatommolekül oder oder2 (Höheres Bild), das eine Doppelbindung hat (o = o). Seine Energiestabilität ist so, dass Sauerstoff niemals als einzelne Atome in der gasförmigen Phase, sondern als Moleküle gefunden wird.
Weil der o2 Er ist homonukleär, linear und symmetrisch, es fehlt ein dauerhaftes Dipolmoment; Daher hängen seine intermolekularen Wechselwirkungen von ihrer molekularen Masse und den Londoner Dispersionskräften ab. Diese Kräfte sind für Sauerstoff relativ schwach, was erklärt, warum es sich bei terrestrischen Bedingungen ein Gas handelt.
Wenn jedoch die Temperatur sinkt oder den Druck, Moleküle oder erhöht oder erhöht2 Sie sind gezwungen zu kohäsiv; bis zu dem Punkt, dass ihre Wechselwirkungen signifikant werden und die Bildung von flüssigem oder festem Sauerstoff ermöglichen. Um sie molekular zu verstehen, ist es notwendig, das O nicht aus den Augen zu verlieren2 als strukturelle Einheit.
Ozon
Sauerstoff kann andere erheblich stabile molekulare Strukturen annehmen; Das heißt, es wird in der Natur (oder innerhalb des Labors) in verschiedenen allotropen Formen gefunden. Das Ozon (unteres Bild) oder3, Zum Beispiel ist es das zweite Alotrop des bekanntesten Sauerstoffs.
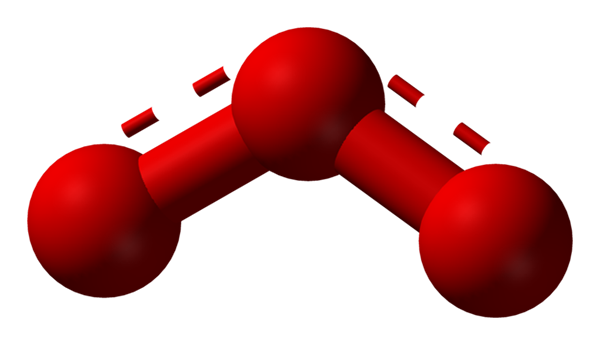 Struktur des Resonanzhybrids, das durch ein Modell von Kugeln und Balken für das Ozonmolekül dargestellt wird. Quelle: Ben Mills über Wikipedia.
Struktur des Resonanzhybrids, das durch ein Modell von Kugeln und Balken für das Ozonmolekül dargestellt wird. Quelle: Ben Mills über Wikipedia. Wieder hält der TEV, erklärt und demonstriert das in der oder3 Es müssen Resonanzstrukturen geben, die die positive formale Belastung des Zentrumsauerstoffs stabilisieren (rot gepunktete Linien); Während.
Kann Ihnen dienen: Löslichkeitsregeln: Allgemeine Aspekte und RegelnAuf diese Weise sind die Links nicht einfach, aber nicht doppelt doppelt. Beispiele für Resonanzhybride sind in ebenso vielen Molekülen oder anorganischen Ionen sehr häufig.
Das Ö2 ICH3, Als Ergebnis, dass ihre molekularen Strukturen unterschiedlich sind, gilt dies auch für ihre physikalischen und chemischen Eigenschaften, Flüssigkeits- oder Kristallphasen (auch wenn beide Sauerstoffatome verbrauchen). Sie theoretisieren diese Synthese in großen Skalen von cyclischem Ozon, deren Struktur der eines rötlichen und sauerstoffhaltigen Dreiecks ähnelt.
Bisher kommen die "normalen Alotrope" des Sauerstoffs an. Es gibt jedoch zwei weitere zu berücksichtigen: o4 ICH8, in flüssigem und festem Sauerstoff gefunden oder vorgeschlagen.
Flüssiger Sauerstoff
Gaser Sauerstoff ist farblos, aber wenn die Temperatur auf -183 ºC abfällt, kondensiert sie in einer hellblauen Flüssigkeit (himmlisch ähnlich). Wechselwirkungen zwischen Molekülen oder2 Jetzt können selbst ihre Elektronen Photonen im roten Bereich des sichtbaren Spektrums absorbieren, um seine charakteristische blaue Farbe widerzuspiegeln.
Es wurde jedoch theoretisiert, dass es in dieser Flüssigkeit mehr als einfache Moleküle gibt oder2, aber auch ein Molekül oder4 (Unteres Bild). Es scheint, als hätte das Ozon ein weiteres Sauerstoffatom "gesteckt", das irgendwie durch die neu beschriebene formale Last interveniert.
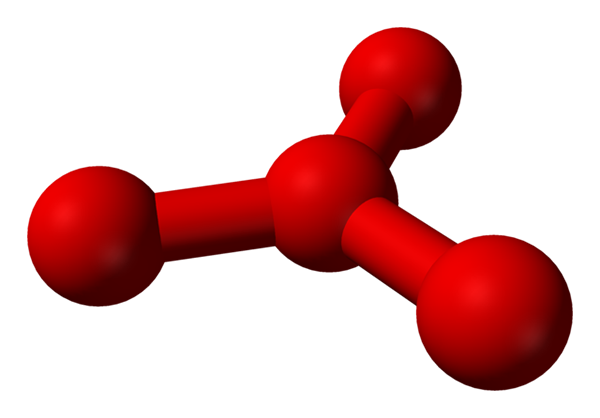 Modell vorgeschlagene Struktur mit Kugeln und Balken für das Tetraoxygenmolekül. Quelle: Benjah-BMM27 [Public Domain]
Modell vorgeschlagene Struktur mit Kugeln und Balken für das Tetraoxygenmolekül. Quelle: Benjah-BMM27 [Public Domain] Das Problem ist, dass nach Computer- und molekularen Simulationen die Struktur für das O4 Es ist nicht genau stabil; Sie sagen jedoch voraus, dass sie als Einheiten existieren (oder2)2, das heißt zwei Moleküle von o2 Sie nähern sich so sehr, dass sie eine Art unregelmäßiger Rahmen bilden (Atome oder nicht miteinander ausgerichtet).
Fester Sauerstoff
Sobald die Temperatur auf -218,79 ºC abfällt, kristallisiert Sauerstoff in einer einfachen kubischen Struktur (γ -Phase). Wenn die Temperatur noch mehr sinkt, litt das Kubikglas über den Übergang zu den β -Phasen (Rhomboédica und bei -229,35 ºC) und α (monoklinisch und bei -249,35 ºC).
Alle diese kristallinen Phasen des festen Sauerstoffs treten bei Umgebungsdruck auf (1 atm). Wenn der Druck auf 9 GPa (~ 9000 atm) steigt, erscheint die δ -Phase, deren Kristalle orange sind. Wenn der Druck weiter auf 10 GPa ansteigt, erscheint der rote feste Sauerstoff oder Phase ε (wieder monoklin).
Phase ε ist etwas Besonderes, weil der Druck so groß ist, dass Moleküle oder2 Sie sind nicht nur als Einheiten untergebracht oder4, aber auch oder8:
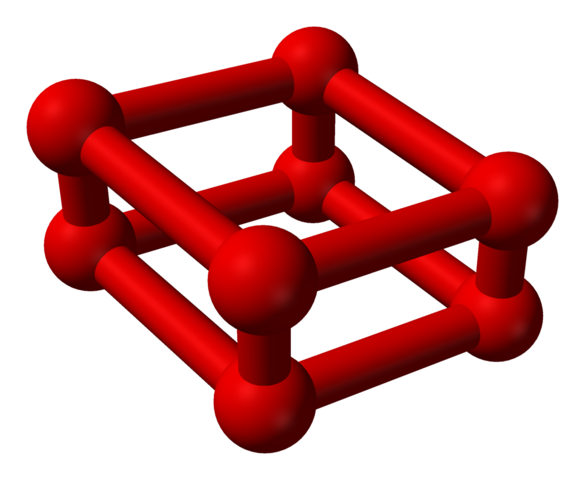 Modellstruktur mit Kugeln und Balken für Oktaoxygenmolekül. Quelle: Benjah-BMM27 [Public Domain]
Modellstruktur mit Kugeln und Balken für Oktaoxygenmolekül. Quelle: Benjah-BMM27 [Public Domain] Beachten Sie, dass dies oder oder8 Es besteht aus zwei Einheiten oder4 wo der unregelmäßige Rahmen bereits erklärt wurde. Es ist auch gültig, es als vier oder als vier oder zu betrachten2 eng ausgerichtet und in vertikalen Positionen. Seine Stabilität ist jedoch unter diesem Druck so, dass der oder4 ICH8 Sie sind zwei zusätzliche Alotrope für Sauerstoff.
Und schließlich haben wir die Phase ζ, metallisch (auf Drücke von mehr als 96 GPa), bei denen der Druck die Elektronen im Glas verteilt macht; Wie bei Metallen.
Wo ist und Produktion
Mineralien
Sauerstoff befindet sich in der Masse das dritte Element des Universums, hinter Wasserstoff und Helium. Es ist das am häufigsten vorkommende Element der Erdkruste, das etwa 50% seiner Masse ausmacht. Es ist hauptsächlich mit Silizium in Form von Siliziumoxid (Sio) kombiniert2).
Sauerstoff ist Teil des unzähligen Minerals. Ebenso befindet es sich als Teil zahlreicher Verbindungen wie Carbonate, Phosphate, Sulfate, Nitrate usw.
Luft
Sauerstoff macht 20,8% atmosphärischer Luft im Volumen aus. In der Troposphäre ist es hauptsächlich wie ein Diatom -Sauerstoffmolekül. Während in der Stratosphäre ist eine gasförmige Schicht zwischen 15 und 50 km der Erdoberfläche wie Ozon.
Ozon wird durch einen elektrischen Schock auf dem Molekül von O erzeugt2. Dieses Alotrop von Sauerstoff absorbiert das ultraviolette Licht der Sonnenstrahlung und blockiert seine schädliche Wirkung auf den Menschen, was in extremen Fällen mit dem Auftreten von Melanomen verbunden ist.
Frisches und salziges Wasser
Sauerstoff ist ein Hauptbestandteil von Meerwasser und Süßwasser aus Seen, Flüssen und Grundwasser. Sauerstoff ist Teil der chemischen Wasserformel und massiert 89% davon.
Andererseits ist die Löslichkeit von Sauerstoff im Wasser relativ niedrig, die Menge an Sauerstoff, die darin gelöst ist.
Lebewesen
Der Mensch wird gebildet, ungefähr 60% Wasser und gleichzeitig reich an Sauerstoff. Darüber hinaus ist Sauerstoff Teil zahlreicher Verbindungen wie Phosphaten, Carbonaten, Carboxylsäuren, Ketonen usw., die für das Leben wesentlich sind.
Sauerstoff ist auch in Polysacchariden, Lipiden, Proteinen und Nukleinsäuren vorhanden; Das heißt, die sogenannten biologischen Makromoleküle.
Es ist auch Teil der schädlichen Verschwendung der Aktivität des Menschen, zum Beispiel: Kohlendioxid und Dioxid sowie Schwefeldioxid.
Biologische Produktion
 Pflanzen sind für die Bereicherung von Sauerstoffluft im Austausch gegen Kohlendioxid verantwortlich, das wir ausatmen. Quelle: Pexels.
Pflanzen sind für die Bereicherung von Sauerstoffluft im Austausch gegen Kohlendioxid verantwortlich, das wir ausatmen. Quelle: Pexels. Sauerstoff kommt während der Photosynthese auf.
Es wird geschätzt, dass mehr als 55% des durch Photosynthese erzeugten Sauerstoffs auf die Wirkung des Marine -Phytoplanktons zurückzuführen sind. Daher ist es die Hauptquelle der Sauerstofferzeugung auf der Erde und ist für die Aufrechterhaltung des Lebens darin verantwortlich.
Industrielle Produktion
Luftverflüssigung
Die wichtigste Methode für industrielle Sauerstoffproduktion wird 1895 erstellt, unabhängig von Karl Paul Gottfried von Linde und William Hamson. Diese Methode verwendet derzeit einige Modifikationen.
Kann Ihnen dienen: Butanone: Struktur, Eigenschaften und VerwendungDer Prozess beginnt mit der Luftkompression, um Wasserdampf zu kondensieren und so zu beseitigen. Dann wird die Luft gesiebt, wenn sie durch eine Mischung aus Zeolith- und Kieselgel, zur Beseitigung von Kohlendioxid, schweren Kohlenwasserstoffen und dem Rest des Wassers durchgeführt wird.
Anschließend werden die Komponenten der flüssigen Luft durch eine fraktionierte Destillation getrennt, wodurch die Trennung der in ihren unterschiedlichen Siedepunkten vorhandenen Gasen erreicht wird. Nach dieser Methode wird Sauerstoff mit 99% Reinheit erhalten.
Wasserelektrolyse
Sauerstoff erzeugt durch stark gereinigte Wasserelektrolyse und mit elektrischer Leitfähigkeit, die 1 µs/cm nicht überschreitet. Wasser wird durch Elektrolyse in seinen Komponenten getrennt. Wasserstoff als Kation bewegt sich zur Kathode (-); Während sich Sauerstoff in Richtung der Anode bewegt (+).
Die Elektroden haben eine spezielle Struktur, um die Gase zu sammeln und anschließend ihre Verflüssigung zu erzeugen.
Wärmeabzersetzung
Die thermische Zersetzung von Verbindungen wie Quecksilberoxid und Wirt (Kaliumnitrat) setzt Sauerstoff frei, die zur Verwendung gesammelt werden können. Peroxide werden auch für diesen Zweck verwendet.
Biologisches Papier
Sauerstoff wird von Phytoplankton und Landpflanzen durch Photosynthese erzeugt. Es kreuzt die Lungenwand und wird im Blut von Hämoglobin erfasst, das sie zu verschiedenen Organen transportiert und dann im Zellstoffwechsel verwendet wird.
In diesem Prozess wird Sauerstoff während des Stoffwechsels von Kohlenhydraten, Fettsäuren und Aminosäuren verwendet, um letztendlich Kohlendioxid und Energie zu produzieren.
Atem kann sich wie folgt schematisieren:
C6H12ENTWEDER6 + ENTWEDER2 => Co2 + H2Oder +Energie
Glukose wird in einem Satz sequentieller chemischer Prozesse metabolisiert, darunter Glykolyse, Krebszyklus, elektronische Transportkette und oxidative Phosphorylierung. Diese Reihe von Ereignissen erzeugt Energie, die sich als ATP ansammelt (Adenosín Triposphat).
Das ATP wird in verschiedenen Prozessen in Zellen verwendet, die den Transport von Ionen und anderen Substanzen durch die Plasmamembran umfassen. die Darmabsorption von Substanzen; die Kontraktion verschiedener Muskelzellen; Der Stoffwechsel verschiedener Moleküle usw.
Polymorphonukleäre und Makrophagenleukozyten sind phagozytische Zellen, die Sauerstoff verwenden können, um Superoxidion, Wasserstoffperoxid und Einzelsauerstoff zu produzieren, die zur Zerstörung von Mikroorganismen verwendet werden.
Risiken
Der hohe Druck des Sauerstoffs kann Übelkeit, Schwindel, Muskelkrämpfe, Sehverlust, Anfälle und Bewusstseinsverlust verursachen. Darüber hinaus verursacht das Atmen von reinem Sauerstoff für einen langen Zeitraum Lungenreizungen, die sich durch Husten und eine Verkürzung der Atmung manifestieren.
Es kann auch die Ursache für die Bildung eines Lungenödems sein: eine sehr schwerwiegende Erkrankung, die die Atemfunktion begrenzt.
Eine Atmosphäre mit hoher Sauerstoffkonzentration kann gefährlich sein, da sie die Entwicklung von Bränden und Explosionen erleichtert.
Anwendungen
Ärzte
Sauerstoff wird Patienten mit Atemversagen verabreicht. Dies ist der Fall von Patienten, die von Lungenentzündung, Lungenödemen oder Emphysem betroffen sind. Sie konnten nicht umweltbezogenen Sauerstoff atmen, da sie ernsthaft betroffen wären.
Patienten mit Herzinsuffizienz in der vorgestellten Flüssigkeitsakkumulation in Alveolen müssen auch Sauerstoff geliefert werden. Wie Patienten, die einen schweren Gefäßunfall erlitten haben (Schlaganfall).
Berufsbedürfnis
Feuerwehrleute, die in einer Umgebung mit unangemessener Belüftung gegen ein Feuer kämpfen, erfordern die Verwendung von Masken und Sauerstoffflaschen, die es ihnen ermöglichen, ihre Funktionen zu erfüllen, ohne ihr Leben in größere Risiken zu bringen.
U -Boote sind mit Sauerstoffproduktionsgeräten ausgestattet, mit denen die Seeleute in einer geschlossenen Umgebung ohne atmosphärische Luftzugang bleiben können.
Die Taucher erledigen ihre Arbeit im Wasser und sind daher aus atmosphärischen Luft isoliert. Sie atmen durch Sauerstoff, die von Röhrchen gepumpt werden, die an ihren Scan angeschlossen sind, oder die Verwendung von Bomben, die am Körper des U -Bootes befestigt sind.
Astronauten führen ihre Aktivitäten in Umgebungen durch, die mit Sauerstoffgeneratoren ausgestattet sind, die überleben.
Industriell
Mehr als 50% des industriell produzierten Sauerstoffs werden bei der Umwandlung von Eisen in Stahl verbraucht. Dem Gusseisen wird ein Sauerstoffstrahl injiziert, um den Schwefel und den vorhandenen Kohlenstoff zu beseitigen. reagieren, um so Gase zu produzieren2 und co2, bzw.
Acetylen wird in Kombination mit Sauerstoff verwendet, um Metallplatten zu schneiden und auch das Schweißen zu produzieren. Sauerstoff wird auch in der Glasproduktion eingesetzt, was die Verbrennung des Backens erhöht, um seine Transparenz zu verbessern.
Atomabsorptionsspektrophotometrie
Die Kombination von Acetylen und Sauerstoff wird verwendet, um Proben unterschiedlicher Herkunft in einem atomaren Absorptionsspektrophotometer zu verbrennen.
Während des Verfahrens wird ein Lichtstrahl aus einer Lampe von der Flamme beeinflusst, die spezifisch für das Element ist, das quantifizieren soll. Die Flamme absorbiert das Licht der Lampe und ermöglicht die Quantifizierung des Elements.
Verweise
- Shiver & Atkins. (2008). Anorganische Chemie. (Vierte Edition). Mc Graw Hill.
- Wikipedia. (2019). Sauerstoff. Abgerufen von: in.Wikipedia.Org
- Richard Van Noordden. (13. September 2006). Nur eine hübsche Phase? Fester roter Sauerstoff: nutzlos, aber entzückend. Erholt von: Natur.com
- Azonano. (4. Dezember 2006). Feste Sauerstoff-E-Phasenkristallstadur. Erholt von: Azonano.com
- Nationales Zentrum für Biotechnologie Information. (2019). Sauerstoffmolekül. Pubchem -Datenbank. CID = 977. Erholt von: Pubchem.NCBI.NLM.NIH.Regierung
- DR. Doug Stewart. (2019). Sauerstoffelement -Fakten. Chemicool. Erholt von: Chemicoolool.com
- Robert c. Brasiliert. (9. Juli 2019). Sauerstoff: Chemisches Element. Encyclopædia Britannica. Erholt von: Britannica.com
- Wiki -Kinder. (2019). Sauerstofffamilie: Eigenschaften von Via Elements. Erholt von: einfach.Wissenschaft
- Advameg, Inc. (2019). Sauerstoff. Erholt von: madehow.com
- Lentech b.V. (2019). Periodentabelle: Sauerstoff. Erholt von: lentech.com
- New Jersey Department of Health und Senior Services. (2007). Sauerstoff: gefährliche Substanz Faktenblatt. [PDF]. Erholt von: NJ.Regierung
- Yamel Mattarollo. (26. August 2015). Industrielle Sauerstoff Industrielle Anwendungen. Erholt von: Altecdust.com
- « Neongeschichte, Eigenschaften, Struktur, Risiken, verwendet
- Histidineigenschaften, Struktur, Funktionen, Lebensmittel »

