Oxidorreduktasen Eigenschaften, Struktur, Funktionen, Beispiele
- 1874
- 551
- Joy Hort
Der Oxidorreduktasen Sie handelt.
Die von diesen Enzymen katalysierten Reaktionen, wie der Name schon sagt.
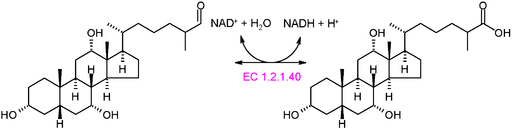 Grafikschema der Reaktion einer Oxidortase vom Typ EC 1.2.1.40 (Quelle: Akane700 [CC BY-SA 3.0 (https: // creativecommons.Org/lizenzen/by-sa/3.0)] über Wikimedia Commons)
Grafikschema der Reaktion einer Oxidortase vom Typ EC 1.2.1.40 (Quelle: Akane700 [CC BY-SA 3.0 (https: // creativecommons.Org/lizenzen/by-sa/3.0)] über Wikimedia Commons) Beispiel für sehr häufige Oxidortenzyme in der Natur ist die von Dehydrogenasen und Oxidasen. Es könnte dem Enzym der Alkohol -Dehydrogenase erwähnt werden, das die Dehydrierung von Ethanol zur Herstellung von Acetaldehyd in einer NAD+ -Hunger oder der umgekehrten Reaktion katalysiert, um Ethanol während der alkoholischen Fermentation zu produzieren, die von einigen kommerziell wichtigen Hefen durchgeführt wurde.
Die Enzyme der Elektronenförderkette in den aeroben Zellen sind Oxidortas,.
[TOC]
Allgemeine Charakteristiken
Oxidoreduktase -Enzyme sind Enzyme, die die Oxidation einer Verbindung und die gleichzeitige Reduktion eines anderen katalysieren.
Diese erfordern normalerweise das Vorhandensein verschiedener Arten von Coenzymen für ihren Betrieb. Coenzyme erfüllen die Funktion des Spendens oder Akzeptanzs.
Diese Coenzyme können das NAD+/NADH -Torus oder das FAD/FADH2 -Drehmoment sein. In vielen aeroben Stoffwechselsystemen werden diese Elektronen und Wasserstoffatome schließlich von den in den Betroffenen beteiligten Coenzymen auf Sauerstoff übertragen.
Sie sind Enzyme mit einem ausgeprägten "Mangel" der Substratspezifität, sodass sie Kreuzungsreaktionen in verschiedenen Arten von Polymeren katalysieren können, unabhängig davon, ob es sich um Protein oder Kohlenhydrate handelt.
Einstufung
Oft basiert die Nomenklatur und Klassifizierung dieser Enzyme sowohl auf dem Hauptsubstrat, das sie verwenden, als auch auf der Art des Coenzyms, das sie zur Funktionsweise benötigen.
Nach den Empfehlungen des Nomenklaturkomitees der Internationalen Union für Biochemie und Molekularbiologie (NC-IBMB) gehören diese Enzyme zur Klasse E.C. 1 und enthalten mehr oder weniger 23 verschiedene Typen (e.C.1.1-e.C.1.23), die sind:
Kann Ihnen dienen: Erythropoietin (EPO): Eigenschaften, Produktion, Funktionen- UND.C. 1.1: die in den Ch-OH-Gruppen von Spendern wirken.
- UND.C. 1.2: die in der Aldehydgruppe oder in der Oxo de los Donor Group wirken.
- UND.C. 1.3: die in den CH-CH-Gruppen von Spendern wirken.
- UND.C. 1.4: die in den CH-NH2-Gruppen von Spendern wirken.
- UND.C. 1.5: die in den CH-NH-Gruppen von Spendern wirken.
- UND.C. 1.6: die in NADH oder NADPH wirken.
- UND.C. 1.7: die auf andere Stickstoffverbindungen wie Spender wirken.
- UND.C. 1.8: die auf die Schwefelgruppen von Spendern wirken.
- UND.C. 1.9: die in den Hämogruppen von Spendern wirken.
- UND.C. 1.10: die bei Spendern wie Diphenolen und anderen verwandten Substanzen wirken.
- UND.C. 1.11: die als Akzeptor auf Peroxid wirken.
- UND.C. 1.12: die auf Wasserstoff als Spender wirken.
- UND.C. 1.13: die auf einfache Spender mit dem Einbau von molekularem Sauerstoff (Oxygenasen) wirken.
- UND.C. 1.14: die auf "gepaarte" Spender mit dem Einbau oder einer Verringerung des molekularen Sauerstoffs wirken.
- UND.C. 1.15: die auf Superoxide als Akzeptoren wirken.
- UND.C. 1.16: die Metallionen oxidieren.
- UND.C. 1.17: die auf CH2 -Gruppen wirken.
- UND.C. 1.18: die auf Proteine wirken, die Eisen enthalten und als Spender annehmen.
- UND.C. 1.19: die auf reduzierte Flavodoxin als Spender wirken.
- UND.C. 1.20: die auf Spender wie Phosphor und Arsen wirken.
- UND.C. 1.21: die in der Reaktion x-H + y-h = x-y wirken.
- UND.C. 1.22: die auf den Halogen der Spender wirken.
- UND.C. 1.23: die C-O-C-Gruppen als Akzeptoren reduzieren.
- UND.C. 1.97: Andere Oxidoryduktasen.
Jede dieser Kategorien enthält auch Untergruppen, in denen Enzyme gemäß der Präferenz von Substraten getrennt sind.
Kann Ihnen dienen: Hauptfolge: Merkmale und BeispieleIn der Gruppe der Oxidoreduktasen, die auf die CH-OH-Gruppen ihrer Spender wirken, gibt es beispielsweise einige, die NAD+ oder NADP+ als Akzeptoren bevorzugen, während andere Cytochrome, Sauerstoff, Schwefel usw. verwenden.
Struktur
Da die Gruppe der Oxidoreduktasen extrem unterschiedlich ist, ist es ziemlich kompliziert, ein definiertes strukturelles Merkmal zu etablieren. Seine Struktur variiert nicht nur von Enzym zu Enzym, sondern auch zwischen Arten oder Gruppe von Lebewesen und sogar Zelle zu Zelle in verschiedenen Geweben.
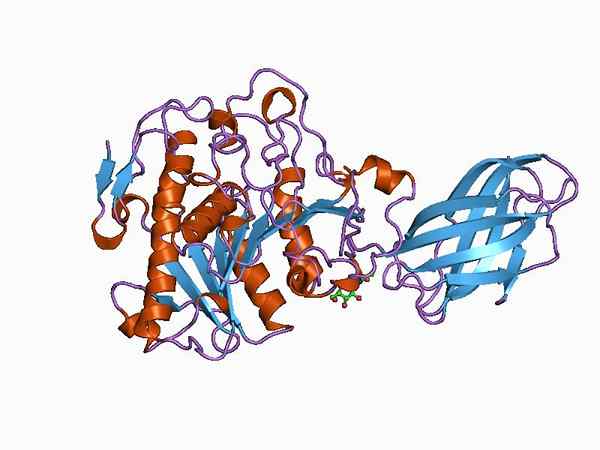
 Bioinformatikmodell der Struktur eines Oxyrotase -Enzyms (Quelle: Jawahar Swaminathan und MSD -Mitarbeiter am Europäischen Bioinformatikinstitut [Public Domain] über Wikimedia Commons)
Bioinformatikmodell der Struktur eines Oxyrotase -Enzyms (Quelle: Jawahar Swaminathan und MSD -Mitarbeiter am Europäischen Bioinformatikinstitut [Public Domain] über Wikimedia Commons) Das Enzympyruvat -Dehydrogenase ist beispielsweise ein Komplex, der aus drei nacheinander verbundenen katalytischen Untereinheiten besteht und als E1 -Untereinheit (Dehydrogenase -Piruvat), die E2 -Untereinheit (Dihydrolipamid -Acetyltransferase) und die E3 -Untereinheit (Dihydrolipamid -Dehycrogenase) (Dihydrolipamid -Dehycrogenase) (Dihydrolipamid -Dehycrogenase), bekannt ist, besteht aus.
Jede dieser Untereinheiten kann wiederum aus mehr als einem Proteinmonomer desselben Typs oder von verschiedenen Typen bestehen, dh homodimer (solche mit zwei gleichen Monomeren), Heterotrimérica (die drei unterschiedliche Monomere haben) usw.
Es handelt sich jedoch normalerweise um Enzyme, die aus Alpha-Hallen und β-plattierten Blättern bestehen, die in verschiedenen Formen angeordnet sind, mit spezifischen intermolekularen Wechselwirkungen verschiedener Arten verschiedener Typen.
Funktionen
Oxidorte Enzyme katalysieren regelmäßige Reaktionen praktisch in allen Zellen aller Lebewesen auf der Biosphäre. Diese Reaktionen sind im Allgemeinen reversibel, bei denen der Oxidationszustand eines oder mehrerer Atome innerhalb desselben Moleküls verändert ist.
Normalerweise benötigen die Oxidorestone zwei Substrate, eine, die als Spender von Wasserstoff oder Elektronen (die oxidiert) und eine, die als Akzeptor von Wasserstoff oder Elektronen (reduziert) wirkt, wirkt.
Diese Enzyme sind für viele biologische Prozesse in verschiedenen Arten von Zellen und Organismen äußerst wichtig.
Sie arbeiten beispielsweise in der Synthese von Melanin (einem Pigment, das in den Zellen der Haut des Menschen gebildet wird), in der Bildung und dem Abbau von Lignin (Strukturverbindung von Pflanzenzellen), bei der Faltung von Proteinen usw.
Es kann Ihnen dienen: Arten, die auf den Galapagos -Inseln eingeführt werdenSie werden industriell verwendet, um die Textur einiger Lebensmittel zu ändern, und Beispiel dafür sind Peroxidasen, Oxidase -Glukose und andere.
Darüber hinaus sind die bekanntesten Enzyme dieser Gruppe diejenigen, die als elektronische Transporter in den Förderketten der Mitochondrienmembran, in Chloroplasten und der inneren Plasmamembran von Bakterien teilnehmen, wo sie transmembranale Proteine sind.
Beispiele für Oxidortas
Es gibt Hunderte von Beispielen für oxidorte Enzyme in Natur und Industrie. Diese Enzyme haben, wie erwähnt, Funktionen von größter Bedeutung für die zelluläre Funktion und damit für das Leben an sich.
Oxiduktasen umfassen nicht nur Peroxidase -Enzyme, Lackierung, Oxidase -Glucose oder Dehydrogenalkohol; Sie kombinieren auch wichtige Komplexe wie das Glyceraldehydenzym 3-phosphat-Dehydrogenase oder die Komplimenus-Dehydrogenase usw., wesentlich aus Sicht des Glukosekatabolismus wesentlich.
Es umfasst auch alle Enzyme des elektronischen Transportkomplexes in der inneren mitochondrialen Membran oder in der inneren Membran von Bakterien, ähnlich wie bei einigen der in den Chloroplasten von Pflanzenorganismen gefundenen Enzymen.
Peroxidasen
Peroxidasen sind sehr unterschiedliche Enzyme und verwenden Wasserstoffperoxid als Elektronenakzeptor, um die Oxidation einer Vielzahl von Substraten, einschließlich Phenolen, Aminen oder Thiolen, zu katalysieren. In seinen Reaktionen reduzieren sie Wasserstoffperoxid, bis es Wasser erzeugt.
Sie sind aus industrieller Sicht sehr wichtig, da sie die Peroxidase des würzigen Radieges die wichtigsten und untersuchten von allen sind.
Biologisch gesehen sind Peroxidasen wichtig für die Eliminierung von Reagenzsauerstoffverbindungen, die die Zellen erhebliche Schäden verursachen können.
Verweise
- Britannica Encyclopaedia. (2019). Abgerufen am 26. Dezember 2019 von www abgerufen.Britannica.com
- Ercili-cura, d., Hupperz, t., & Kelly, a. L. (2015). Enzymatische Modifikation der Milchprodukttextur. Bei der Änderung der Lebensmittelstruktur (pp. 71-97). Woodhead Publishing.
- Mathews, c. K., Van Holde, K. UND., & Ahern, k. G. (2000). Biochemie. HINZUFÜGEN. Wesley Longman, San Francisco.
- Nelson, d. L., Lehninger, a. L., & Cox, m. M. (2008). Lehninger Prinzipien der Biochemie. Macmillan.
- Nomenklaturkomitee der Internationalen Union für Biochemie und Molekularbiologie (NC-IBMB). (2019). Von www abgerufen.Qmul.AC.UK/SBCS/IUBMB/Enzym/Index.Html
- Patel, m. S., Nemeria, n. S., Furey, w., & Jordan, f. (2014). Die Pyruvat-Dehydrogenase-Komplexe: Strukturbasisfunktion und -regulation. Journal of Biological Chemistry, 289 (24), 16615-16623.

